הכותבים: Mir R, Mircea DM, Ruiz-González MX, Brocal-Rubio P, Boscaiu M, Vicente O
תרגם: אריה סעדה.
תקציר: דו-פרק חופי Cakile maritima הוא צמח מלחה חד-שנתי בשרני ממשפחת המצליבים, הנפוץ ברחבי העולם וגדל בעיקר לאורך חופי הים. צמיחתו מיטבית בתנאי מליחות מתונה (100 מילימולר NaCl),כפי שנמדד על פי ייצור הביומסה והזרעים. ריכוזי מלח גבוהים יותר, עד 500 מילימולר NaCl, משפיעים באופן ניכר על צמיחתו אך אינם פוגעים בשרידותו. דו-פרק חופי מצמצם את נזקי רעילות הנתרן באמצעות מגוון אסטרטגיות, בהן התאמות מבניות ופיזיולוגיות, ויסות מעבר ואיזון יונים, סינתזת אוסמוליטים והפעלה של מנגנוני נוגדי חמצון.
סינתזת אוסמוליטים (מתייחסת לייצור מולקולות קטנות בתאי הצמח, המסייעות בשמירה על מאזן המים והיונים בתנאי עקה אוסמוטית, כגון מליחות גבוהה. אוסמוליטים, כגון פרולין, בטאין וסוכרים מסוימים, פועלים כחומרים מייצבים המגנים על חלבונים ומבנים תוך-תאיים, שומרים על לחות התא ומפחיתים את הנזק הנגרם ממלחים. הודות ליכולתו לייצר תרכובות משניים בעלי ערך רפואי ותזונתי, וכן בשל תכולת השמן הגבוהה בזרעיו, דו-פרק חופי מהווה מועמד מבטיח לגידול מסחרי פוטנציאלי במסגרת חקלאות מליחה בת-קיימא. בסקירה זו, אנו מדגישים את חשיבותו של דו-פרק חופי כמודל לחקר מנגנוני עמידות למלח וכגידול חקלאי בר-קיימא לנוכח המלחת הקרקעות ושינויי האקלים, ולפיתוח אסטרטגיות לחקלאות בת-קיימא.
מליחות הקרקע והמים הולכת ומחריפה, הן בהיקף השטחים החקלאיים הנפגעים והן בחומרת הפגיעה ביבולים. רוב מיני הצמחים עמידים למליחות נמוכה או מתונה לכל היותר. עם זאת, חלק קטן מאוד (<1%) ממיני הצמחים, המכונים צמחי מלחה (Halophytes), מסוגלים לשרוד ולהשלים את מחזור חייהם בבתי גידול טבעיים שבהם רמת המליחות מגיעה ל-200 מילימולר נתרן כלורי (NaCl) או יותר.


דו-פרק ימי Cakile maritima הוא צמח ממשפחת המצליבים הגדל בחוף הים , צלמו מימין איתן שפירא © ומשמאל עוז גולן ©.
1. מבוא
1.1. צמחי מליחה וחקלאות מליחה
מליחות הקרקע מתייחסת לריכוז המומסים האנאורגניים בתמיסת הקרקע, לרבות יונים טעונים מסיסים, מומסים שאינם יונים ויונים היוצרים צמדי יונים. מבחינה חקלאית, קרקעות המזוהמות ממלחים מסווגות לשלושה סוגים: קרקעות מלוחות (saline soils), קרקעות נתרניות (sodic soils), וקרקעות מלוחות-נתרניות. (מליחות הקרקע מתייחסת לריכוז המומסים האנאורגניים במי הקרקע, לרבות יונים טעונים מסיסים, מומסים שאינם יונים ויונים היוצרים צמדי יונים. מבחינה חקלאית, הקרקעות הפגועות ממלחים מסווגות לשלושה סוגים: קרקעות מלוחות, קרקעות נתרניות , וקרקעות מלוחות-נתרניות (saline-sodic soils) [1].
בטבע, הצטברות מלחים בקרקע ובמים מתרחשת בעיקר עקב תהליכי בליה והתפוררות של סלעים שטחיים, חדירת מי ים לאזורים בקרבת הים ועלית מי תהום מלוחים[1]. עלייה טבעית בריכוז המלחים בקרקע ובמים מכונה "המלחה ראשונית" (primary salinisation), אשר גורמת לכך שאזורים אלה אינם מתאימים בדרך כלל לחקלאות, בשל רגישותם היחסית של רוב הגידולים החקלאיים למליחות. בנוסף, אזורים חקלאיים מסורתיים רבים, במיוחד כאלה המעובדים בהשקיה באזורים צחיחים וצחיחים למחצה, מושפעים מתופעה המכונה "המלחה משנית" (secondary salinisation). המלחה זו נגרמת כתוצאה מהצטברות יונים בקרקע שמקורם במי ההשקיה, וכן בשל פרקטיקות חקלאיות בלתי נאותות, כגון שימוש יתר בתוספי קרקע במטרה לשפר את איכות הקרקע לטווח הארוך, שימוש מוגזם בחומרים אגרוכימיים (כגון חומרי הדברה, קוטלי עשבים ודשנים), והשלכת פסולת חקלאית ללא פיקוח.
המלחה מעכבת באופן שגם המלחה ראשונית וגם המלחה משנית מהוות אתגר משמעותי לחקלאות בת קיימא, משום שהן פוגעות בפוריות הקרקע ומקשות על גידול יבולים לאורך זמן, מעוות את הצמיחה ופוגעת בכושר ההישרדות של מרבית מיני הצמחים, ובהם כל הגידולים החקלאיים החשובים. נוסף על כך, הצטברות מלחים בקרקע משנה את המבנה, הכימיה והמערכת האקולוגית והמיקרוביולוגית שלה, ובכך פוגעת בעקיפין בתפקוד הצמחים [2].
העלייה בטמפרטורה הגלובלית, יחד עם הפעילות החקלאית, תורמות להגברת המליחות בקרקעות מעובדות, מה שהופך את ייצור המזון ומוצרים המופקים מצמחים לבעיה שהולכת ומחריפה. על פי המפה הגלובלית של קרקעות שנפגעו ממליחות (Global Map of Salt-Affected Soils – GSASmap), למעלה מ-3% מהקרקעות העליונות (כ-5 עד 30 הסנטימטרים הראשונים) ו-6% משכבת הקרקע העמוקה יותר בעולם, מושפעות ממליחות או מעודף יוני נתרן, כאשר האזורים הצחיחים והצחיחים למחצה הם הנפגעים העיקריים [3].
מצב זה מחייב בחינה מחדש של המודל החקלאי הקונבנציונלי, כדי להבטיח את זמינותם של משאבי הטבע והמזון לדורות הבאים. הקהילה המדעית משקיעה מאמצים רבים בפיתוח זני גידולים חדשים בעלי עמידות משופרת לתנאים סביבתיים קשים, ובכללם מליחות [4]. עם זאת, חרף ההתקדמות בהבנת התגובות הגנטיות והפיזיולוגיות של צמחים למליחות, ההצלחה בפיתוח זני גידולים עמידים למליחות נותרה מוגבלת. הסיבה העיקרית לכך היא שמליחות לא נתפסה כבעיה הראויה לקבל קדימות בתוכניות השבחה חקלאיות, שכן היא משפיעה בעיקר על אזורים חקלאיים מקומיים ומוגדרים [5].
שימוש בשונות תוך-מינית הניב הצלחות בפיתוח מספר זני אורז עמידים למליחות [6,7], אך ההצלחות בהשבחת החיטה ההצלחות היו מצומצמות יותר [5]. תוכניות השבחה מסורתיות, שהתבססו על הכלאת עגבניות מסחריות עם מינים קרובים, כגון עגבניית פנלי Solanum pennellii, הובילו לפיתוח קווי השבחה בעלי עמידות משופרת לתנאי מליחות [8]. באופן דומה, החדרת הגן Nax2 מחיטת האינקורן (Triticum monococcum) לחיטת דורום מסחרית הפחיתה את הצטברות הנתרן בגוף הצמח ושיפרה את ביצועי הגידול בתנאים מליחות, וכל זאת ללא פגיעה ניכרת בצמיחה [9]. שימוש בכנות עמידות למליחות, בעלות מנגנונים יעילים להוצאת נתרן ו/או כלוריד, נבחן בגידולי עצים כגון תפוחים [10], הדרים [11] וגפנים [12], אך יישומו המסחרי עדיין דורש מחקר נוסף [5].
בעגבניות הושגה עמידות למליחות באמצעות כנות של עגבניות וחצילים, שהתאפיינו ביכולת משופרת לסינון נתרן [13,14]. כמו כן, צמחי אורז טרנסגניים מהזן japonica, שביטאו ביתר את הגן OsNHX1 המקודד למשאבה משחלפת נתרן/מימן , הציגו עמידות גבוהה יותר למליחות מתונה בהשוואה לצמחי הביקורת [15]. דוגמאות אלו מצביעות על הצלחה מסוימת בהשבחת גידולים עמידים למליחות, אך טרם פותחה גישה אגרונומית מקיפה שתאפשר יצירת גידולים עמידים למליחות תוך שמירה על תכונות חקלאיות מסחריות מיטביות.
בשנים האחרונות, השימוש בחיידקי ריזוספירה מקדמי צמיחה עמידים למליחות (PGPR – Plant Growth-Promoting Rhizobacteria) התגלה כגישה מבטיחה להתמודדות עם בעיית המליחות בחקלאות. חיידקים אלו מייצרים מטבוליטים משניים מועילים, סידרופורים (חלבונים קושרי ברזל), הורמונים ואנזימים, ומשפרים תכונות הקרקע, כגון איזון יוני, זמינות מים וחומרי הזנה, ובכך תורמים לצמח [16]. האינטראקציה בין צמחים ל-PGPR משפרת תהליכים פיזיולוגיים מרכזיים ומגבירה את יעילות הפוטוסינתזה, ובכך תורמת לצמיחה ולהתפתחות מיטבית של הצמח בתנאי מליחות. לכן, יישום חיידקים עמידים למליחות בשטח מהווה גישה בת-קיימא להגברת ייצור המזון.
בנוסף לגישות השבחה קלאסיות (כגון הכלאות וברירה טבעית), הנדסה גנטית או טכנולוגיות גנומיות חדשות, כגון עריכת גנום, שילוב PGPR בגידולים חקלאיים עשוי לשפר את עמידותם למליחות. יתרה מכך, ניתן לנצל צמחי בר חסינים לסביבות קיצוניות לצרכים חקלאיים, שכן הם עשויים לצמצם את ההשפעה השלילית של פעילות חקלאית על הסביבה ולתרום לשימור קרקעות מעובדות. במקרה של קרקעות מלוחות, גידול מסחרי של צמחי מליחה מהווה את הבסיס למה שמכונה חקלאות (ביו)מליחה 17] ].
חקר הביולוגיה של צמחי מלחה יכול לספק גם תובנות חשובות לגבי האסטרטגיות שבהן משתמשים מינים אלו כדי לשרוד בתנאי מליחות קיצוניים [18]. הבנות אלו עשויות להיות מיושמות, לפחות באופן חלקי, בגידולים חקלאיים מסורתיים, שרובם הם גליקופיטים, כלומר צמחים הרגישים למליחות וניזוקים ממנה.


דו-פרק ימי Cakile maritima הוא צמח ממשפחת המצליבים הגדל בחוף הים , צלמו מימין איתן שפירא © ומשמאל עוז גולן ©.
1.2. הגדרת צמחי מלחה (Halophytes)
צמחי מלחה הם קבוצה מצומצמת (פחות מ-1% מהצמחייה העולמית) של מיני צמחים בעלי עמידות טבעית למליחות. צמחים אלו מסווגים לשני סוגים עיקריים:
- הלופיטים מוחלטים, מובהקים (Obligate halophytes) – צמחים הדורשים סביבה מלוחה קבועה לצורך צמיחה מיטבית.
- הלופיטים מותנים (Facultative halophytes) – צמחים המסוגלים לסבול מליחות ברמה מסוימת, אך משגשגים ומתפתחים טוב יותר בסביבה שאינה מלוחה או ברמת מליחות נמוכה.
עם זאת, סיווגם המדויק של מינים מסוימים כהלופיטים עדיין מצוי בדיון, וקביעת מספרם המדויק אינה חד משמעית. ההגדרה המקובלת ביותר מגדירה הלופיטים כצמחים המסוגלים לגדול ולהשלים את מחזור חייהם בריכוזי מלח של 200 מילימולר NaCl ומעלה [19]. עם זאת, חוקרים אחרים הציעו קריטריון מחמיר פחות, של 85 מילימולר NaCl כערך סף להגדרת צמח מלחה [20]. לפי קריטריון זה, ניתן לכלול כ-6,000 מיני צמחים יבשתיים ובתי גידול של מים מלוחים כצמחי מלחה [20].
הגדרה מרחיבה יותר מתארת צמחי המלחה כמינים המסוגלים לגדול באופן טבעי ולהשלים את מחזור חייהם בקרקעות מלוחות, שבהן מרבית הצמחים אינם יכולים להתקיים [21]. רשימה מקיפה יותר של צמחי מלחה ברחבי העולם, הכוללת גם מיוהלופיטים (miohalophytes) – מינים המשגשגים בסביבה שאינה מלוחה, אך מסוגלים לשרוד ברמות מליחות נמוכות (כלומר, 20 עד 100 מילימולר NaCl), ומונה כ-26,000 מינים [22].
ארונסון (Aronson 1989,2016) הגדיר 1,560 מיני צמחים עמידים למליחות על סמך יכולתם לגדול בתנאים של מוליכות חשמלית של 7.8 דציסימנס למטר (השווה ל-80 מילימולר NaCl ) במהלך שלבים משמעותיים במחזור חייהם [23]. צמחי מלחה מצויים במשפחות רבות, ומניתוח רשימה של 1,861 מינים זוהו 139 משפחות ו-636 סוגים [22]. עם זאת, הגדרת הלופיטים וסיווגם מורכבת, שכן תגובת הצמח למליחות תלויה בגורמים רבים, בהם ריכוז המלחים בקרקע ובמים, שלב ההתפתחות של הצמח בעת החשיפה למלח, ומשך זמן החשיפה. דיון מעמיק יותר בהגדרה ובסיווג של צמחי מלחה מופיע במאמר [24].
כדבר אחרון, חשוב לציין כי מאגר המידע המקוון eHALOPH (נכון ל-2024) אוסף ומארגן מידע על למעלה מ-1,200 מיני צמחים בעלי דרגות מסוימות של עמידות טבעית למליחות. בין אלה נכללים צמחי מלחה מובהקים, המשגשגים בתנאי מליחות נמוכה (למשל, 100 מילימולר- NaCl) ומסוגלים לגדול גם בריכוזי מלח של 200 מילימולר NaCl (שווה ערך למוליכות חשמלית של 20 דציסימנס למטר) ואף ברמות מליחות גבוהות יותר, וכן מינים המסוגלים לשרוד בריכוזי מלח של כ-80 מילימולר NaCl (שווה ערך למוליכות חשמלית של 7.8 דציסימנס למטר). מעבר לרשימת המינים, המאגר מספק מידע רלוונטי מתוך פרסומים מדעיים בנוגע להתאמות מורפולוגיות, פיזיולוגיות וביוכימיות של צמחי מלחה, בתי הגידול הטבעיים שלהם, וכן שימושיהם הכלכליים המדווחים. זהו מקור חיוני ובעל ערך עבור קהילת חוקרי צמחי המלחה [25].
1.3 תגובות של צמחי מלחה למליחות גבוהה
התגובה התאית למליחות מפעילה מסלול איתות מוקדם, הכולל ייצור מגיבי חמצן עצימים (ROS) וגלי +Ca², וכן מנגנונים מאוחרים שנועדו למנוע את ההשפעות הרעילות של יוני נתרן בתוך התאים. זיהוי נתרן בתא מוביל לייצור מהיר של ROS, אשר גורם לעקה חמצונית המאופיינת בפגיעה באיזון החמצון-חיזור (redox homeostasis), חמצון ליפידים, חמצון חלבונים ועיכוב בפעילות אנזימטית [18].
בנוסף, ריכוז יוני סידן בנוזל התוך-תאי (ציטוזול) עולה, ושיאי ריכוזי הסידן מזוהים על ידי חלבוני (CBL) Calcineurin B-like, אשר מתקשרים עם קינאזות אינטראקטיביות של CBL ומפעילים זרחון של חלבוני מטרה [26]. הזרחון של חלבוני המטרה במסלול CBL-CIPK גורם להפעלת משאבות נתרן-מימן (Na⁺/H⁺ antiporters) שונות; סוג אחד ממוקם בקרומית התא ותפקידו להוציא יוני הנתרן מהציטוזול אל מחוץ לתא והסוג השני, ממקום בקרוo חללית התא ומטרתו לכלוא אותם בתוך החללית, כדי למנוע את הצטברותם בציטוזול. שתי המשאבות עובדות יחדיו כדי לווסת את רמות הנתרן להביא לאיזון אוסמוטי בתוך ומחוץ לתא, ולעמידות הצמח למליחות [26].
בנוסף, ריכוז יוני סידן בציטוזול (נוזל התא) עולה, ושיאי הריכוז מזוהים על ידי חלבוני Calcineurin B-like, אשר מתקשרים עם קינאזות אינטראקטיביות של CBL ומפעילים זרחון של חלבוני מטרה [26]. הזרחון של חלבוני המטרה במסלול CBL-CIPK גורם להפעלת משאבות פרוטונים, היוצרות מפל פרוטונים (H⁺ gradient) המנוצל לטובת הוצאת יוני נתרן מהציטוזול אל מחוץ לתא או לכליאתם בתוך החללית באמצעות משחלפי נתרן-מימן- Na⁺/H⁺ antiporters.
הזרחון מפעיל משחלפי נתרן-מימן מסוגים שונים:
✔ הסוג הראשון ממוקם בקרום התא ותפקידו להוציא יוני נתרן מהציטוזול אל מחוץ לתא.
✔ הסוג השני ממוקם בקרום החללית (טונופלסט) ותפקידו לכלוא את הנתרן בתוך החללית, ובכך למנוע את הצטברותו בציטוזול.
שתי המשאבות פועלות יחד כדי לווסת את רמת הנתרן, לאזן את הלחץ האוסמוטי בתוך ומחוץ לתא, ולשפר את עמידות הצמח למליחות [26]. האופן שבו צמחים, ובמיוחד צמחי מלחה, מתמודדים עם הצטברות נתרן בקרקע תלוי במנגנונים פנימיים שונים, שאינם בלעדיים זה לזה, ומבוססים על התאמות אנטומיות, פיזיולוגיות, ביוכימיות וגנטיות. למרות שצמחי מלחה וגליקופיטים (צמחים הרגישים למליחות) חולקים מנגנוני תגובה דומים, המערכות התאית והאנזימטית של צמחי מלחה יעילות יותר בנטרול עודפי נתרן [27].
אחד ממנגנוני ההגנה המרכזיים בתנאי מליחות גבוהה הוא סילוק נתרן באמצעות מסלול ה-SOS) Salt Overly Sensitive). בקצרה, SOS3 הוא חלבון קושר-סידן המזהה שיאי ריכוז סידן הנגרמים עקב הצטברות נתרן בתאים. כתוצאה מכך, הוא מתקשר עם חלבון קינאז מסוג סרין/תראונין, SOS2, ומפעיל אותו [28]. אינטראקציה זו מובילה בהמשך לזרחון ולהפעלת SOS1, שהוא משחלף נתרן/מימן (Na+/H+ antiporter) בקרום התא, המסייע להוצאת נתרן מהציטוזול אל מחוץ לתא [29]. למרות שמסלול תגובה זה קיים הן בצמחי מלחה והן בגליקופיטים, יעילותו גבוהה יותר בצמחים עמידים למליחות כמו המצליבים- Eutrema salsugineum ו-Schrenkiella parvula, בהשוואה לקרובתם תּודְרָנִית לְבָנָה [30]. עם זאת, עדיין לא ברור אם מגמה זו תקפה באופן גורף לכל צמחי המלחה.
בנוסף, צמחי מלחה מפעילים מערכות נוגדות חמצון יעילות, המסייעות בהפחתת הנזק התאי הנגרם מעלייה חדה ברמות מגיבי חמצן עצימים (ROS) בציטוזול. התגובה נוגדת החמצון בצמחים יכולה להיות אנזימטית או לא-אנזימטית.
- מנגנון אנזימטי: אנזימים כמו סופראוקסיד דיסמוטאז (SOD), קטלאז (CAT), דהידרואסקורבט רדוקטאז (DHAR) ואסקורבט פראוקסידאז (APX), בין היתר, מפרקים את ה-ROS הרעילים והופכים אותם לתוצרים בלתי מזיקים ולמים.
- מנגנון לא-אנזימטי: בצמחים קיימים גם מנגנוני סילוק גיבי חמצן עצימים שאינם מבוססי אנזימים, אשר חשובים במיוחד למניעת הצטברות חמצן סינגלטי (^1O₂) ורדיקל הידרוקסיל (OH∙), שכן חומרים אלו אינם מתפרקים באמצעות מסלולים אנזימטיים [31]. הבסיס למערכת הלא-אנזימטית הוא צבירת תרכובות נוגדות חמצון, כגון אסקורבט וגלותתיון, גליצין-בטאין ופרולין, אשר קושרים ומנטרלים מולקולות מגיבי חמצון עצימים [31].
למרות שתהליכי פירוק וקטילת ROS מפחיתים את ההשפעות הרעילות שלהם, הם אינם המנגנונים המרכזיים המאפשרים לצמחי מלחה מובהקים לשרוד בתנאי מליחות גבוהה. במקום זאת, המינים העמידים ביותר למליחות מסוגלים לשמור על ריכוזי נתרן נמוכים בתא, וכך לצמצם את רמות ה-ROS והעקה חמצונית כבר משלב החשיפה הראשוני למליחות [31]. תהליכי פירוק וניטרול של מגיבי חמצן עצימים (ROS) מצמצמים את השפעתם המזיקה, אך הם אינם מהווים את מנגנון ההתמודדות העיקרי של צמחי מלחה מובהקים עם מליחות גבוהה. במקום זאת, מינים עמידים במיוחד למליחות מסוגלים לשמור על ריכוזי נתרן נמוכים בתא כבר משלב הזיהוי הראשוני של המליחות, וכך למנוע מראש את ההפעלה המוגברת של ייצור ROS ואת הצורך להתמודד עם עקה חמצונית [31].
בנוסף, צמחי מלחה פיתחו התאמות מבניות ייחודיות המאפשרות להם להתמודד עם תנאי מליחות קיצוניים. התאמות אלו כוללות:
- עלים או גבעולים סוקולנטיים, המסייעים באגירת מים ובדילול ריכוזי המלח ברקמות [32,33,34].
- שכבות אפידרמיס עבות יותר בתנאי עקה מליחה, המעניקות הגנה מפני אידוי מוגבר וחדירת מלחים.
- פיוניות שקועות המסייעות בצמצום איבוד מים.
- ליגניפיקציה (התעצות דופן התאים) של הרקמות, אשר מחזקת את הצמח ומספקת עמידות בפני תנאי עקה קיצוניים [35].
- מערכת שורשים קצרה, המאפשרת התמודדות עם מפל הריכוזים האוסמוטי המאפיין קרקעות מלוחות [18].
חלק מצמחי המלחה פיתחו מבנים ייחודיים להפרשת מלחים, המסייעים בוויסות עומס היונים ברקמות:
- בלוטות מלח (Salt glands) – מבנים המפרישים מלח ישירות מחלקיו הפנימיים של העלה אל פני השטח.
- שלפוחיות מלח (Salt bladders) – חללים מיוחדים המצטברים על פני העלים, בהם נאגר באופן זמני עודף מלח, עד שהוא נשטף בגשם או בטל [35].
צמחי מלחה שונים מציגים מנגנוני עמידות מגוונים, כאשר לכל מין עשויה להיות אסטרטגיה אחת או שילוב של מספר מנגנונים להתמודדות עם מלחים. על פי אופן ההתמודדות שלהם עם מליחות, ניתן לחלקם לשלוש קטגוריות עיקריות:
- צמחים נמנעים ממלח (Excluders) – צמחים אלה מונעים את חדירת המלח לרקמותיהם ומפחיתים את ספיגתו, בדרך כלל באמצעות התאמות מבניות או פיזיולוגיים במערכת השורשים.
- צמחים צוברי מלח (Accumulators/Includers) – צמחים הצוברים מלחים בתוך התאים והרקמות, אך נמנעים מהשפעותם הרעילות באמצעות מנגנונים תאיים וביוכימיים, כגון אגירת יונים בחלוליות או הפרשת אוסמוליטים המווסתים את מאזן המים בתא.
- צמחים מפרישי מלח (Conductors) – צמחים המצוידים בבלוטות מלח מיוחדות, המאפשרות הפרשה פעילה של מלחים מתוך הרקמות הפנימיות של העלים אל פני השטח, ובכך נמנעת הצטברות מלח מזיקה בתאים [36].
בסקירה זו ריכזנו מידע מדווח על דו-פרק חופי, צמח מלחה מובהק הנפוץ בחופי ימים ברחבי העולם של כל חמש היבשות. הסקירה מתמקדת במאפייניו הביולוגיים, הגנטיים והאקולוגיים, בתגובותיו למליחות ובשימוש הפוטנציאלי שלו כמודל לחקר בסיסי של מנגנוני עמידות למלח. בנוסף, אנו דנים בערכו הכלכלי של דו-פרק חופי כגידול מסחרי פוטנציאלי במסגרת חקלאות מליחה, עם יישומים מגוונים, בהם גידול קולינרי יוקרתי, גידול להפקת שמן, צמח מרפא, ומקור לחומרים בעלי עניין תעשייתי. יתרה מזאת, נדון בפוטנציאל השימוש של הצמח לשיפור קרקעות מלוחות ולפיטורמדיאציה (טיהור סביבתי) של קרקעות המזוהמות במתכות כבדות.
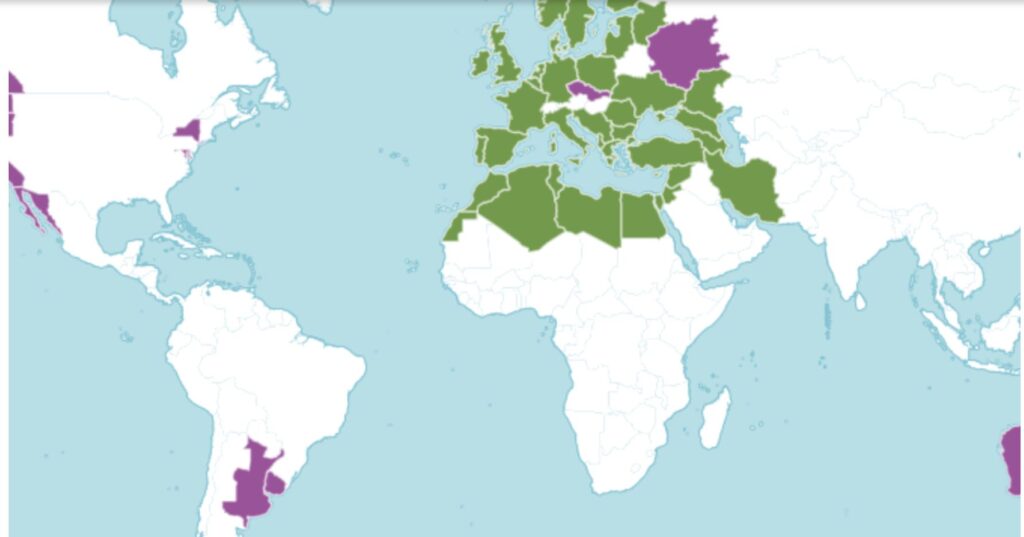
מפת התפוצה של דו-פרק חופי, מתוך אתר KEW 2025; בצבע ירוק- תפוצה טבעית, בצבע סגול-התפשטות אנתרופוגנית כתוצאה מסחר בינלאומי מאב המאה החמש-עשרה.
2. מאפייני דו-פרק חופי
דו-פרק חופי, המכונה באנגלית Sea Rocket, הוא צמח חד-שנתי ממשפחת המצליבים, שמוצאו מאירופה, אך הוא נפוץ לאורך חופי כל חמש היבשות (מפת תפוצה). צמח זה אינו עולה בגובהו על כ-40 ס"מ, בעל הסתעפות מרובה, ויכול לכסות שטח של עד מטר קוטר. העלים קרחים ובשרניים, וצורתם עשויה להיות תמימה, דמוית אזמל הפוך או שסועה-מנוצה [37,38]). הפרחים בעלי ארבעה עלי כותרת בצבע לבן עד סגול, בקוטר של עד 25 מ"מ, ומפיצים ניחוח חזק. דו-פרק חופי מתרבה בעיקר בהאבקה זרה על ידי חרקים שונים, בעוד שהאבקה עצמית היא נדירה.

הפירות ירוקים ורכים כשהם בלתי בשלים, אך עם הבשלתם הם מתכהים ונעשים מעוצים. הם מכילים כמויות גבוהות של ליפידים ומורכבים משני פרקים (תרמילים מחולקים): הפרק העליון ניתק בקלות מהצמח, צף על פני מי הים ויכול לשרוד עד שנה במים מלוחים, ובכך מסייע להפצה רחוקה, ואילו הפרק התחתון לרוב נותר בקרבת צמח האם, ובכך תורם להמשכיות האוכלוסייה המקומית [39,40]).
מערכת השורשים של הצמח כוללת שורש שיפודי מרכזי המגיע לאורך של כ-40 ס"מ, וממנו מסתעפים גבעולים אופקיים. דו-פרק חופי הוא מין דיפלואידי (2n=18), בעל גנום בגודל 719 מגה-בסיסים. מדובר בצמח קטן יחסית, בעל מחזור חיים קצר של כשלושה חודשים מהנביטה עד ייצור הזרעים, ויכולת רבייה גבוהה המגיעה לכ-10,000 זרעים לצמח יחיד [41,42].
דו-פרק חופי מותאם לטווח רחב של אזורי אקלים, החל מאזורים צחיחים למחצה ועד לאזורים ארקטיים, מה שמעיד על עמידותו הן לחום וליובש קיצוני והן לטמפרטורות נמוכות ולכפור. אוכלוסיותיו קצרות-החיים והמתחדשות מצויות כמעט בלעדית באזורי חוף, המאופיינים בקרקעות דלות במזינים, בעליות תקופתיות של מליחות הקרקע עקב חדירת מי ים, ברוחות חזקות וברסס מלח המגיע מהתנפצות גלי הים [43].
קרקעות חוליות באזורי חוף אינן יציבות ומשתנות כתוצאה מרוחות, גלים ותנועת מים, מאופיינות בחלחול מהיר ואובדן מים, וערכן התזונתי נמוך ותלוי בהצטברות חומר אורגני מתפרק [40]. משום כך, דו-פרק חופי הוא מין עמיד היכול לגדול בקרקעות דלות יחסית ובתנאים אקלימיים מגוונים. באופן ספציפי, דו-פרק חופי זקוק לחנקן בקרקע לצורך פוטוסינתזה וצמיחה מיטבית, אך אינו דורש מאקרו-מינרלים נוספים [43]. בנוסף, כמויות קטנות של חומר אורגני וקרקעות בעלות תגובה מעט בסיסית (בשל נוכחות סידן פחמתי CaCO₃ שמקורו בשברי קונכיות) משפרות את צמיחתו [40]. בסך הכול, דרישותיו הסביבתיות והתזונתיות של דו-פרק חופי נמוכות, מה שהופך אותו למועמד אידיאלי לגידול, במיוחד באדמות שוליות, כפי שהוצע גם לגבי צמחי מלחה אחרים [44].
המרחקים הגנטיים בין פרטים של דו-פרק חופי מאזורים שונים באירופה נמצאו גבוהים, כפי שהודגם באמצעות סמנים מולקולריים מסוג RAPD (ריבוי פולימורפי רנדומלי של DNA) ו-ISSR (רצפים חוזרים פשוטים) [45]. בנוסף, שונות גנטית משמעותית זוהתה גם באוכלוסיות דו-פרק חופי מחופי תוניסיה, באמצעות ניתוחים גנטיים מבוססי אלוזימים [37].
השונות הגנטית הגבוהה של דו-פרק חופי מוסברת, בין השאר, בשיעור הנמוך של האבקה עצמית, ביכולתו להאבקה זרה עם קרובו – דו-פרק קהה Cakile edentula [46]. וביכולת התפשטותו הגבוהה הודות לזרמי הים, המאפשרים פיזור זרעים למרחקים גדולים [37]. שונות זו מקנה למין זה גמישות רבה והסתגלות למגוון רחב של סביבות גידול. פרטים של דו-פרק חופי, שנאספו מאזורי אקלים מגוונים בצפון אפריקה, הציגו הבדלים במאפיינים מורפולוגיים (כגון גודל התרמילים וצורת העלים) [47] וכן בהבדלים בתגובות הביוכימיות שלהם למליחות. כך למשל, נמצא כי:
- בתנאי ביקורת (ללא שינויי מליחות או גורמי עקה), אוכלוסיות מאזורים גשומים הפיקו ביומסה יבשה רבה יותר.
- בתנאי מליחות מתונה (100 מילימולר NaCl), אוכלוסיות מאזורים צחיחים דווקא הציגו עלייה במשקל היבש, בעוד שאוכלוסיות מאזורים גשומים הראו ירידה במשקל היבש [48,49].
- בריכוזי מלח גבוהים (400 מילימולר NaCl), הירידה היחסית במשקל היבש הייתה קטנה יותר באוכלוסיות מאזורים צחיחים בהשוואה לאלו מאזורים גשומים [48,49].
- מגמות דומות נצפו גם ביחס לשטח העלווה ולמשקל הצמח בתנאים מלוחים ולא מלוחים [50].
ממצאים אלו מצביעים על כך שאוכלוסיות מאזורים צחיחים נוטות להתנהג כצמחי מלחה מובהקים, בעוד שאוכלוסיות מאזורים לחים מתנהגות יותר כצמחי מלחה מותנים. ייתכן כי מסלולים מולקולריים ייחודיים מעורבים בהסתגלות לאזורים צחיחים, אם כי הידע בנושא עדיין מוגבל. מחקר השוואתי של פרופיל החלבונים (proteomics) באוכלוסיות מאזורים לחים וצחיחים שנחשפו למליחות זיהה הצטברות מוגברת של 33 חלבונים משותפים לשתי האוכלוסיות, לצד 88 חלבונים ייחודיים לאוכלוסיות מאזורים צחיחים ו-64 חלבונים ייחודיים לאוכלוסיות מאזורים לחים [51]. ממצאים אלו מצביעים על כך שתוכניות ביטוי גנים שונות מופעלות באוכלוסיות מאזורי אקלים שונים, דבר המשקף את כושר ההסתגלות הגבוה של המין לתנאים סביבתיים משתנים.
3. תגובות שונות של דו-פרק חופי לעקת מלח
בחקלאות, רעילות נקבעת לפי ריכוזו של רכיב מסוים בקרקע או במצע גידול אחר, שממנו ואילך נפגעת צמיחת הצמח. הן נתרן +Na והן כלוריד −Cl נחשבים יונים רעילים להתפתחות הצמח, אך רמת הסף שממנה מתחילה רעילות היא ייחודית לכל מין ומשתנה בין מינים שונים.
מליחות הקרקע מובילה לעלייה בלחץ האוסמוטי, מפחיתה את זמינות המים לצמח, וגורמת להצטברות יוני נתרן בתאים דרך תעלות לא-סלקטיביות, תוך שיבוש האיזון האוסמוטי התקין של התא. בתנאים מלוחים, יכולת הרבייה והצמיחה הווגטטיבית של הצמח לרוב נפגעות.
תגובת דו-פרק חופי למליחות נחקרה בהיבטים ביולוגיים שונים, כולל נביטת זרעים, צמיחה וגטטיבית כללית וכשירות להעמדת צאצאים מוצלחים [52]. הסעיפים הבאים סוקרים את מנגנוני ההסתגלות השונים של דו-פרק חופי שנחקרו ותוארו.
3.1 התאמות מבניות ופיזיולגיות של דו-פרק חופי
דו-פרק חופי הוא צמח בשרני המצטיין ביכולתו לאגור מים בעליו. מנגנון זה, האופייני לצמחי מלחה רבים, מסייע בדילול יוני מלח רעילים בתוך הרקמות ובהפחתת רעילותם. עם זאת, הקשר בין דרגת הבשרניות של דו-פרק חופי לרמות המליחות שבהן הוא גדל טרם הובהר. מחקרים מצאו כי צמיחתו של דו-פרק חופי משתפרת ברמות מליחות מתונות, אך ברמות גבוהות (מעל 200 מילימולר NaCl) נצפתה ירידה בביומסה, ככל הנראה בשל הפחתה במספר העלים והפרקים, צמצום שטח העלים וקיצור אורך הפרקים והשורשים [53]. יתרה מזו, מספר הפיוניות בשני צדי העלים go העלייה בריכוז המלח באופן דו-שלבי, כאשר הצפיפות המרבית של פיוניות נרשמה בריכוז של 300 מילימולר NaCl. ההתאמה האנטומית זו של הפיוניות נמצאת במתאם ליחס חילוף גזים גבוה יותר ולהגברת קצב ההטמעה [53]. נמצא כי קיימים שני טיפוסי עלים שונים בדו-פרק חופי: עלים שלמים ועלים מנוצים-מחולקים שעמידים יותר לתנאי עקה [38].
יתרה מזו, מספר הפיוניות הן בצד העליון והן בצד התחתון של העלים עולה בתגובה לעלייה בריכוז המלח באופן דו-שלבי, כאשר הצפיפות המרבית של פיוניות נרשמה בריכוז של 300 מילימולר NaCl. התאמה מבנית זו נמצאה במתאם עם התאמה פיזיולוגית – יחס חילוף גזים גבוה יותר, המאפשר קליטה מוגברת של פחמן דו-חמצני ושחרור מהיר של חמצן ואדי מים. קצב חילוף גזים גבוה מעיד לרוב על פעילות הטמעה מוגברת, ובצמחי מלחה התאמות אלו מסייעות לא רק לשיפור הטמעה, אלא גם לוויסות קצב הדיות (transpiration), כלומר נידוף המים דרך הפיוניות ולשיפור העמידות למליחות [53].
נמצא כי בדו-פרק חופי קיימים שני טיפוסי עלים שונים: עלים פשוטים ועלים מחולקים-מנוצים אשר עמידים יותר לתנאי עקה [38]. ניתוח היסטולוגי נוסף של עלי דו-פרק חופי חשף מבנים ייחודיים הקשורים להתמודדות עם מליחות, בהם תאי אפידרמיס גדולים עם דפנות מעובות וקוטיקולה מעובה, המפחיתים איבוד מים, תאי פרנכימה לאגירת מים, והידתודות (hydathodes) המעורבות בהפרשת תרכובות מינרליות פנימיות בתהליך הגוטציה (Guttation).
ההידתודות מורכבות ממספר פתחים דמויי פיוניות, הממוקמים לרוב בקצות העלים או הגבעולים ומחוברים ישירות לצרורות ההובלה דרך רקמת אפיתם (epithem). רקמה זו היא חלק מהמזופיל, אך בשונה מתאי הפרנכימה הרגילים, היא אינה מתמחה בפוטוסינתזה אלא בהפרשת מים. גוטציה היא תופעה שבה תמיסה של מלחים ומינרלים בעיקר, מופרשים דרך פתחי ההידתודות [וראה גרנות 2024, מראה ספרות מס.93] . תהליך זה מתרחש בעיקר בלילה או בשעות הבוקר המוקדמות, כאשר הלחות היחסית גבוהה והפיוניות סגורות, מה שמונע איבוד מים דרך מנגנון הדיות. לחץ אוסמוטי במערכת צינורות ההובלה (בעקבות לחץ אוסמוטי בשורשים) מניע מים במעלה מערכת ההובלה, ולבסוף הם נפלטים כטיפות קטנות על פני העלים. יתרה מזו, נמצאו הצטברויות של גבישי מלח בדפנות התאים האפידרמליים הווסיקולריים. גבישים אלו מרוכזים בעיקר בנקבוביות שבדפנות התאים, בעיקר בצד העליון והתחתון של העלים. תופעה זו מעידה על כך שתאים אלה מעורבים באופן פעיל בוויסות היונים בצמח, הן באמצעות אגירה והן באמצעות הפרשה של עודפי מלחים [38].
דו-פרק חופי מציג התאמות מבניות ופיזיולוגיות מגוונות, הכוללות שינויים במספר הפיוניות, צורת העלים ומבנה הרקמות, אשר מסייעות לו להפחית את רעילות המלחים ולהתמודד עם עקת מלח.
3.2. יצירת זרעים ונביטתם של דו-פרק חופי בתנאי מליחות
נביטת זרעים היא שלב קריטי להתבססות הנבט ולהתפתחותו הסופית של הצמח. זזרעי צמחי מלחה רגישים בדרך כלל למליחות גבוהה, והצמחים מפתחים עמידות למלח במהלך הצמיחה הווגטטיבית [52]. נמצא כי נביטת זרעי דו-פרק חופי נפגעת בנוכחות 200 מילימולר נתרן כלורי או יותר, אך השפעה זו הפיכה, כפי שהודגם בניסויי התאוששות [52]. מכאן שהמליחות אינה פוגעת בחיוניות הזרעים, אלא רק מעכבת את תהליך הנביטה. בתנאי מליחות מתונה, הנביטה מתעכבת, והשיעור הסופי של הנביטה פוחת במעט.
לצורך הבנת השפעת המליחות על הנביטה נערך מחקר שהתבסס על ניתוח פרופיל החלבונים (proteome), ובו זוהו חלבונים שנצברו באופן שונה. במחקר זה נבחנו זרעים שנזרעו במצע בעל מליחות מתונה (75 מילימולר NaCl) בהשוואה לתנאי ביקורת. במחקר זה זוהו חלבונים המעורבים בגליקוליזה, מטבוליזם של חומצות אמינו, פוטוסינתזה וקיפול חלבונים, אשר הצטברו באופן שונה במהלך הנביטה [54]. באופן ספציפי, נמצא השתחררותם והתפרקותם של חלבוני האגירה בזרעים, החיוניים לנביטה תקינה ולהתבססות הנבט, התעכבו בתנאי מליחות. הגורם המדויק לעיכוב זה אינו ברור לחלוטין, אך ייתכן שזמינות מים נמוכה עקב לחץ אוסמוטי בתנאים מלוחים מעכבת תהליכים הידרוליטיים החיוניים לפירוק חומרי אגירה [54].
יתרה מזאת, זוהו 12 חלבונים לכל היותר הקשורים למסלולים מטבוליים ראשוניים שונים, ובהם פוטוסינתזה, גליקוליזה וגלוקונאוגנזה, אשר הצטברותם הושפעה מתנאי עקת מלח.
העובדה שזרעי דו-פרק חופי שטופלו ב-NaCl הראו דפוס הצטברות חלבונים תקין אך מעוכב מחזקת את ההנחה שהזרעים נותרים חיוניים, אך הנביטה מתעכבת בשל תרדמה הנגרמת ממליחות [54]. גם ייצור הזרעים מושפע ממליחות במהלך התפתחות צמח האם. זרעים שהתפתחו בתנאי עקת מלח חמורה (כלומר, 400 מילימולר NaCl) היו קלים יותר והציגו שיעור הפלות גבוה יותר [52,53] בהשוואה לזרעים של צמחים שלא נחשפו למליחות גבוהה. עם זאת, המנגנון הביוכימי המדויק העומד בבסיס שינויים אלו במהלך התפתחות הרבייה טרם הוסבר. ייתכן כי הוא קשור, לפחות במידה מסוימת, להשפעת המליחות במהלך הצמיחה הווגטטיבית.
3.3 ויסות הלחץ האוסמוטי בתאי דו-פרק חופי
מנגנוני ההתמודדות של צמחים עם שינויים בלחץ האוסמוטי התאי הנגרמים ממליחות מבוססים על שני עקרונות מרכזיים:
- שמירה על ריכוז נמוך של יונים בציטופלזמה, באמצעות הוצאה פעילה של יוני נתרן מחוץ לתא, אגירתם הזמנית בתוך החלוליות, וכן מנגנוני ויסות נוספים לשמירה על איזון יוני. החלוליות בצמחים תורמות במיוחד להפחתת רעילות של יוני נתרן, לא רק באמצעות קליטתם ואגירתם בתוכן, אלא גם באמצעות שחרורם הפעיל בעיתוי המתאים.
- ביוסינתזה של מומסים אורגניים (אוסמוליטים), המסייעים בשמירה על לחץ אוסמוטי תקין בתאים [55].
בצמחים שטופלו בריכוזי מלח עולים נצפתה הצטברות של יוני נתרן Na⁺ וכלור Cl⁻ בעלים, אך דפוס ההצטברות שלהם היה שונה: הנתרן הצטבר ביחס ישר לריכוז המלח, בעוד שהצטברות הכלוריד עלתה בריכוזי מלח נמוכים אך נותרה קבועה בריכוזים גבוהים יותר [56]. בנוסף, רמות הקטיונים סידן Ca²⁺, אשלגן K⁺ ומגנזיום Mg²⁺ היו נמוכות יותר לעומת צמחים שגודלו ללא מלח. תצפיות אלו מוסברות, לפחות חלקית, בפעילות מוגברת של משאבות פרוטונים (H⁺-ATPase) בקרום התא ובקרום החלולית [56].
דפוס הצטברות הנתרן בשורשים היה שונה מזה שנצפה בעלים – הצטברותו הייתה פחות משמעותית [57], ולעיתים אף לא נצפתה לאחר חשיפה פתאומית למליחות גבוהה [58]. ניסוי פרמקולוגי שנערך על תרביות תאים מבודדות של דו-פרק חופי הראה כי חדירת יוני נתרן לציטופלזמה הופחתה חלקית כאשר יושמו מעכבים של תעלות קטיונים לא-סלקטיביות (NSCCs – Non-Selective Cation Channels). הצטברות עודפת של נתרן בתאים הובילה למוות תאי, אך נמצא כי שיעור התמותה של תאי דו-פרק חופי היה נמוך יותר בהשוואה לקרובו תּודְרָנִית לְבָנָה (Arabidopsis thaliana), צמח גליקופיטי הרגיש למלח [58].
יתרה מזאת, נמצא כי דו-פרק חופי מפעיל מסלול חלופי דמוי-SOS להוצאת נתרן מהתאים. ביטוי הגנים CmSOS1, CmSOS2 ו-CmSOS3 בתרבית תאים של דו-פרק חופי נותר יציב, דבר המעיד על מנגנון הגנה בסיסי מפני הצטברות נתרן [42].
בנוסף לוויסות היונים, דו-פרק חופי מפעיל מנגנונים אוסמוליטיים לשמירה על לחץ אוסמוטי תקין. מחקרים הראו כי:
- ריכוז הפרולין (Proline) עלה רק לאחר חשיפה למליחות גבוהה (400 מילילמור NaCl), דבר המעיד על תגובה ביוכימית ייחודית לתנאי עקה קיצוניים, השונה מהתגובה למליחות מתונה (100 מילילמור NaCl), שבה צמיחתו מיטבית [59].
- רמות הפוליפנולים עלו באופן משמעותי בצמחים מאזורים צחיחים לאחר 20 ו-28 ימים של חשיפה למליחות, אך לא בצמחים מאזורים לחים [50].
- גישה מטבולומית הראתה כי מליחות נמוכה עוררה ביוסינתזה של מספר חומצות אמינו וסוכרים, בעוד שמליחות גבוהה הובילה לעלייה ניכרת בייצור חומצות אמינו וסוכרים ולדיכויי ייצור של חומצות אורגניות [60].
- תרכובות ספציפיות כגון גליצין-בטאין (Glycine-betaine) ו-GABA זוהו בצמחים שנחשפו למליחות קיצונית [60].
- לא נמצאו שינויים ברמות α- ו-γ-טוקופרול בעלים של דו-פרק חופי במהלך 24 השעות הראשונות של החשיפה למלח, תוצאה הדומה למה שנמצא בקרובו הגליקופיטי תֻּדְרָנִית לְבָנָה [61].
3.4. תגובות נוגדות חמצון של דו-פרק חופי לעקת מלח
השפעתם הרעילה לתאים של מגיבי חמצן עצימים (Reactive Oxygen Species, ובקיצור ROS), הנוצרים במהירות עם זיהוי נתרן בתא, ניתנות לצמצום באמצעות פעילות של אנזימים נוגדי חמצון או באמצעות סינתזה של מולקולות המנטרלות אותם [31]. דו-פרק חופי מפעיל תגובה נוגדת חמצון יעילה המונעת עקה חמצונית בתאים שנגרמת כתוצאה ממגיבי חמצן עצימים. מערכת נוגדת החמצון מופעלת במהירות, בתוך 24 השעות הראשונות של החשיפה למלח, ונשמרת לפחות למשך 20 ימי הטיפול.
השוואת התגובות נוגדות החמצון של דו-פרק חופי שטופל בריכוז גבוה של מלח (400 מילימולר NaCl) לאלו של הצמח הגליקופיטי תּודְרָנִית לְבָנָה (Arabidopsis thaliana), שטופל בריכוז נמוך יותר (100 מילימולר NaCl), הצביעה על דפוסי תגובה שונים, המסבירים את מנגנוני ההסתגלות השונים של מינים אלו למליחות גבוהה [62]. סמנים של עקה חמצונית, כגון מי חמצן ומלונדי-אלהיד (MDA), הגיעו לשיאם כעבור ארבע שעות טיפול בדו-פרק חופי, בעוד שבתּודְרָנִית לְבָנָה נרשמה עלייה מתמשכת ברמותיהם במשך 72 השעות הראשונות. בהתאם לכך, פעילות האנזימים נוגדי החמצון, ובהם פרוקסידאז (POD), קטלאז (CAT) וסופראוקסיד דיסמוטאז (SOD), הגיעה לשיאה לאחר ארבע שעות טיפול בדו-פרק חופי, בעוד שבתּודְרָנִית לְבָנָה הפעלת האנזימים הייתה לא רק מאוחרת יותר, אלא גם נמוכה יותר בעוצמתה [62].
נוסף על כך, נצפתה תגובה נוגדת חמצון שונה בין תנאי עקה מתונה לתנאי עקה חמורה. פעילות האנזימים נוגדי החמצון, ובהם קטלאז (CAT), פרוקסידאז (POD), אסקורבט פרוקסידאז (APX), גלוטתיון רדוקטאז (GR) ודיהידרואסקורבט רדוקטאז (DHAR), עלתה בעקבות חשיפה ממושכת (20 יום) למליחות מתונה (100 עד 200 מילימולר NaCl). לעומת זאת, בריכוז מלח גבוה (400 מילימולר NaCl), העלייה בפעילותם הייתה מזערית יחסית [63]. בהתאם לכך, דליפת אלקטרוליטים וריכוזי סמנים לעקה חמצונית, כגון מלונדי-אלדהיד (MDA) ומי חמצן, היו גבוהים יותר לאחר 20 ימים של מליחות קיצונית בהשוואה לרמות שנמדדו בתנאי מליחות מתונה [63].
ממצאים אלו מצביעים על כך שמערכת נוגדת החמצון האנזימטית מופעלת במהירות עם זיהוי נתרן בתא, ומשקפים את ההבדלים בתגובות האנזימטיות לנוגדי חמצון בהתאם לריכוז המלח. מנגנון זה נמצא יעיל יותר בריכוזים נמוכים, דבר התואם את ההתפתחות האופטימלית של דו-פרק חופי בתנאי מליחות מתונה.
מחקר מפורט יותר של איזואנזימים (isozymes) ושל האנזים סופראוקסיד דיסמוטאז (SOD) בדו-פרק חופי הראה כי למרות שאיזואנזימי Fe-SOD הם הדומיננטיים במהלך התפתחות הצמח, איזואנזימי CuZn-SOD הם אלו שמופעלים בעיקר בתגובה למליחות קיצונית [64].
כל הנתונים הללו מצביעים על כך שדו-פרק חופי מפעיל במהירות וביעילות מערכת נוגדת חמצון אנזימטית בתגובה לעקת מלח, תוך שמירה על פעילות גבוהה של אנזימים נוגדי חמצון לכל אורך תקופת החשיפה. תגובה זו מפחיתה נזקי חמצון ומהווה מאפיין טיפוסי לצמחי מלחה, שכן גליקופיטים קרובים אינם מפגינים דינמיקה כזו. למעשה, התגובה תלויה לא רק במין הצמח אלא גם בגנוטיפים שלו, שכן אוכלוסיות דו-פרק חופי המותאמות לאזורים צחיחים הציגו מערכת נוגדת-חמצון אנזימטית פעילה יותר בהשוואה לאוכלוסיות מאזורים לחים [48].
לצד פעילות אנזימטית, דו-פרק חופי מפעיל גם מנגנוני הגנה מטבוליים המבוססים על סינתזה וצבירה של מטבוליטים נוגדי חמצון. נמצא כי עלים שנקטפו מצמחים שטופלו בריכוזי מלח שונים במשך 20 ימים צברו כמויות עולות של דה-הידרו-אסקורבט (DHAS) וגלוטתיון מחוזר (GSH) באופן תלוי-מינון [63]. עם זאת, בניסוי שנערך, במהלך 72 השעות הראשונות של החשיפה למלח, נמדדה הצטברות גלוטתיון הן בעלים והן בשורשים, כאשר מצב החמצון-חיזור של הגלוטתיון נותר קבוע לאורך תקופה זו [57]. בנוסף, הצטברות אסקורבט (ויטמין C) נצפתה גם היא בעלים ובשורשים במהלך פרק זמן זה [57].
ממצאים אלו מצביעים על כך שתהליכי הביוסינתזה של מטבוליטים נוגדי חמצון אלו מופעלים במהירות עם זיהוי המלח, ורמותיהם נשמרות לפחות במהלך 20 הימים הראשונים של הטיפול. באופן מעניין, הצטברות חומצה אסקורבית פחתה כאשר הצמחים נחשפו להלם מליחות חריף בריכוז מלח גבוה (400 מילימולר NaCl), דבר המצביע על שינוי בתגובה הביוכימית תחת תנאי עקה חמורים [58].
לסיכום, בנוסף להתאמות מבניות כגון בשרניות, דו-פרק חופי מפעיל מגוון מנגנוני הגנה ביוכימיים בתגובה לתנאי מליחות גבוהה. כצמח צובר מלחים (includer), הוא צובר יוני נתרן וכלוריד רעילים באיבריו העל-קרקעיים, תוך הפחתת השפעותיהם הרעילות של מגיבי חמצן עצימים הנגרמים מהמלח. הוא עושה זאת באמצעות הפעלת אנזימים נוגדי חמצון, יצירה וצבירה של מולקולות לוכדות מגיבי חמצן עצימים. על אף שהנושא נחקר פחות, דווח גם על הפעלה של ביטוי גנים הקשור לנטרול נתרן באמצעות מסלול SOS. מסלול זה Salt Overly Sensitive pathway ובשמה הזמני זיהוי-זרחון-זריקה (זז"ז) היא מערכת חלבונית שמסייעת לצמחים להיפטר מעודפי נתרן באמצעות משאבות ולמנוע רעילות התא ממלח [42].
לא ניתן לקבוע באופן חד-משמעי את התרומה היחסית של ויסות מעבר היונים ושל הפעלת מערכות נוגדות חמצון, אנזימטיות ולא-אנזימטיות, לתגובתו של דו-פרק חופי למליחות. ככל הנראה, שני סוגי התגובות תורמים לעמידותו הגבוהה של המין למליחות, ומאפשרים לו לשרוד בריכוזי מלח של עד 400 מילימולר NaCl (איור 2).
יתרה מכך, ייתכן שאוכלוסיות המותאמות לאזורי אקלים שונים נבדלות ביעילות מנגנוני התגובה הכלליים שלהן, כאשר אוכלוסיות המותאמות לאזורים צחיחים נראות עמידות יותר למליחות בהשוואה לאלו מאזורים לחים יותר [48,49,59]. מאחר שרוב המחקרים שנערכו על דו-פרק חופי מוגבלים לאוכלוסיות מצפון אפריקה, אין לשלול את האפשרות שיתגלו בעתיד מנגנוני תגובה למלח יעילים יותר או פחות של מין זה באקלימים ובאזורים גאוגרפיים נוספים.
3.5. תגובות דו-פרק חופי לעקות נוספות
כצפוי, מרבית המחקרים שפורסמו על תגובותיו של דו-פרק חופי לעקות סביבתיות עוסקים במליחות. עם זאת, דווחו גם השפעות של עקות א-ביוטיות נוספות, כגון בצורת או מחסור בחומרי הזנה חיוניים, על צמחים ממין זה.
- בצורת גורמת לעיכוב בצמיחת הצמח, אך דו-פרק חופי מפגין יכולת התאוששות גבוהה לאחר חזרת תנאי הלחות התקינים. במהלך חשיפה לבצורת מופעלות תגובות פיזיולוגיות וביוכימיות, בהן שינוי בקצב חילופי הגזים בתהליך ההטמעה (stomatal conductance) והצטברות אוסמוליטים כמו גליצין-בטאין ופרולין [65].
- מחסור באשלגן גרם לעקה חמצונית בדו-פרק חופי, שהפעילה תגובה נוגדת חמצון המבוססת על הגברת פעילותם של אנזימים נוגדי חמצון, בדומה למה שנצפה בתנאי מליחות גבוהה [67].
- מחקר המבוסס על ניתוח פרופיל החלבונים (proteome) שנעשה על צמחים שנחשפו לבצורת זיהה שינויים משמעותיים בפרופיל החלבונים בהשוואה לצמחים שגדלו בתנאי השקיה רגילים או לצמחים שהתאוששו לאחר עקת מחסור במים [66].


דו-פרק ימי Cakile maritima הוא צמח ממשפחת המצליבים הגדל בחוף הים , צלם איתן שפירא ©
4. הערך הכלכלי של דו-פרק חופי
דו-פרק חופי הוא צמח בר נפוץ, הממלא תפקיד אקולוגי חשוב בבתי גידול חופיים [43,68]. אף שהמין אינו מגודל באופן מסחרי, יחידים שנאספו מבתי גידול טבעיים שימשו באופן מסורתי כצמחי מאכל או כצמחי מרפא [69].
בעקבות שינויי האקלים, חקלאים, שוקי הצריכה והצרכנים פונים מחדש למינים מסורתיים עמידים או לצמחי בר חסיני עקות, דוגמת צמחי מלחה [42], ובהם גם דו-פרק חופי, כבסיס לשיקום גידולים חקלאיים מסחריים קיימים או לפיתוח גידולים חדשים, המותאמים לתנאי אקלים קיצוניים.
להלן יוצגו ויידונו שימושים מעשיים אפשריים של דו-פרק חופי.
4.1. דו-פרק חופי כמקור מזון
צמחי מלחה שימשו כמקור מזון במשך תקופות ממושכות [69]. מינים מסוימים, כמו תמר מצוי, קריתמון ימי וסלק מצוי, נפוצים במסורות קולינריות באזורים שונים בעולם [69]. לעומת זאת, צריכתם של מיני צמחי מלחה אחרים הוגבלה בעיקר לתקופות רעב [69]. בשנים האחרונות, החיפוש אחר טעמים חדשים במטבח הגורמה, יחד עם יתרונותיהם התזונתיים ועמידותם הגבוהה למלח, הפך את צמחי המלחה לאופציה אטרקטיבית לפיתוח מסחרי כגידולי מאכל [69,70].
דו-פרק חופי הוא צמח מאכל, ורוב איבריו אכילים. קיימים מתכונים לשימוש בשורשים, בעלים ובגבעולים צעירים, בפרחים ובפירותיו [69]. העלים והגבעולים הצעירים הם מרכיבים טובים לסלטים טריים, בעוד שהעלים הבוגרים, בשל מרירותם, מומלצים לשימוש במרקים או כירק תיבול, וכן להפקת תמציות טעם או רטבים. באופן דומה, הפרחים הטריים הם מרכיב גורמה לסלטים טריים, ומוסיפים טעם מעט מריר למרקים. ניתן לטחון את השורשים להכנת קמח. לבסוף, ניתן לאכול פירות צעירים חיים, ופירות בשלים או לא בשלים לחלוטין משמשים כמקור להפקת שמן [69].
ניתוח תזונתי של עלי דו-פרק חופי חשף מאפיינים תזונתיים מתאימים לצריכה, כאשר תכולת המים [68,71] ורמות החומצה האוקסלית [72] בצמח זה גבוהות במיוחד בהשוואה לצמחי מלחה אכילים אחרים. נוסף על כך, דו-פרק חופי צובר כמויות גבוהות של פלבנואידים ותרכובות פנוליות, התורמות לפעילות נוגדת חמצון גבוהה [50,73], והופכות אותו לאטרקטיבי בשל ערכו התזונתי ויתרונותיו הבריאותיים. עלים, גבעולים ותרמילים צעירים של דו-פרק חופי נמכרים באופן מסחרי כירק מוחמץ בשווקים מקומיים.
זרעי הצמח מכילים ריכוז שמן גבוה, הדומה לזה של קרובו התרבותי, כרוב הנפוס, ולכן נחשב למין שמני [74]. עם זאת, ניתוח הרכב חומצות השומן הראה כי בהשוואה לשמן זית, רמות החומצה האולאית נמוכות יחסית, בעוד שחומצה אירוסית (Erucic acid) נצברת בכמות גבוהה יותר [74]. רמות אלו משתנות בהתאם לגנוטיפ [75] ולריכוז המלחים בקרקע [41,56]. תצפיות אלו מצריכות זהירות בשימוש בזרעי דו-פרק חופי כמקור לשמן למאכל אדם ובעלי חיים, שכן נמצא כי חומצה אירוסית עלולה לגרום להצטברות שומנים בשריר הלב ולנגעים מיוקרדיאליים [76]. לפיכך, חיפוש אחר זני בר טבעיים עם רמות נמוכות או ללא חומצה אירוסית עשוי להפוך את דו-פרק חופי למין אידיאלי להפקת שמן אכיל. לדוגמה, בחלק מהאוכלוסיות של דו-פרק חופי שנבדקו במצרים, חומצה אירוסית נמצאה מתחת לסף הזיהוי, ואילו החומצה האולאית הייתה חומצת השומן הדומיננטית [77]. נוסף על כך, איכות השמן משתנה בין אוכלוסיות המותאמות לאזורי אקלים שונים, גם בתוך אותו אזור גאוגרפי [47,75]. אפשרות נוספת היא פיתוח תוכניות השבחה ליצירת זני דו-פרק חופי דלי חומצה אירוסית, כפי שנעשה בעבר בזני כרוב הנפוס [78].
לפיכך, דו-פרק חופי הוא מקור מזון מתאים בשל טעמו הייחודי, תכונותיו התזונתיות ותכולת השמן שבו, ומאפשר מגוון דרכי שימוש, מה שהופך אותו למין אידיאלי למטבח חדשני. נוסף על כך, נמצא כי לצמח משך שימור ארוך יחסית בתנאי קירור בסיסיים (4°-C), בין אם באחסון פתוח (יבש) או בתוך מיכל סגור (לח), יתרון משמעותי לשימוש מסחרי לאחר הקטיף. נמצא כי המרקם הפריך והתורגות של העלים והגבעולים נשמרו במשך 15 ימים בטמפרטורה של 4-°C, אם כי צבע העלים החל לדהות מירוק לצהוב (איור 3). לאחר 28 ימי אחסון, העלים איבדו את מרקמם וצבעיהם, אך טעמם היה דומה לזה של הימים הראשונים לאחר הקטיף (איור 3). עם זאת, תצפיות אלו הן חזותיות בלבד, ועדיין לא נבדק האם שינויים אלה מלווים בשימור התכונות התזונתיות והקולינריות של דו-פרק חופי. כך או כך, נראה כי הצמח אינו מין מתכלה בקלות, תכונה חשובה בשוק המזון.




דו-פרק ערבי Cakile arabica מחולות ואדי רם בדרום ירדן, צילם אורי פרגמן ספיר ©. איור הקו מהפלורה של חצי-האי ערב (Miller 1996): דו-פרק ערבי הוא מין ויקרי לדו-פרק ימי האנדמי לחולות הפנימיים של חצי-האי ערב וכנראה המין הקדום ביותר בסוד והקרוב לסוג שלח. חוקר הסוג רודמן משער כי זהו מין המוצא לדו-פרק חופי אשר עבר לגדול בחופי המפרץ הכספי ועבר משם לחופי הים-התיכון והאוקינוס האטלנטי; משם "קפץ" לחופי צפון מזרח אמריקה והמשיך להתפשט דרומה לחופי מרכז אמריקה; משם "קפץ" לחופי האוקינוס הפציפי ועלה לחופי קליפורניה ואורגון שם התמיין למין ויקרי חדש – דו-פרק קליפורני – Cakile californica.
4.2. שימושים רפואיים של דו-פרק חופי
יכולתם של צמחי מלחה לשרוד בתנאים קיצוניים הופכת אותם למתאימים לפיטורמדיאציה (phytoremediation) – שיקום קרקעות ומקורות מים מזוהמים. לדו-פרק חופי יש מנגנון טבעי לקליטה ולצבירה של יוני נתרן וכלור ברקמותיו, מה שהופך אותו לצמח אידיאלי להסרת מלחים מקרקעות חקלאיות מלוחות ולשיקומן. באמצעות שילובו במחזורי גידול (crop rotation) או בגידול משולב (intercropping), ניתן להפחית את ריכוזי המלח בקרקע, לשפר את פוריותה ולהכשירה לגידולים מסורתיים [82]. בהקשר זה, פותחה שיטה הנקראת "חקלאות מעגלית מלוחה" (Circular Halophyte Mixed Farming – CHMF), המבוססת על גידול וקציר של צמחי מלחה באזורים מלוחים, במטרה לשקם את הקרקע ולהכשירה לשימוש חקלאי [83]. מודל זה נוסה בהצלחה עם מספר מיני צמחי מלחה שנמצאו יעילים במיוחד בספיחת מלחים ושיפור איכות הקרקע [84].
פרט ליכולתו לספוח מלחים, דו-פרק חופי מפגין גם רמות פעילות גבוהות של האנזים גלוטתיון-S-טרנספראז (Glutathione-S-transferase; GST), המשתתף בהמרה ביוכימית של תרכובות קסנוביוטיות – חומרים זרים כגון מזהמים סביבתיים ורעלנים אורגניים. נמצא כי דו-פרק חופי מציג סבילות גבוהה לקדמיום (Cd) ואף צובר אותו בגבעוליו. יתרה מזו, מקדם הטרנסלוקציה (translocation factor) של קדמיום בצמח זה גבוה מזה של כרוב החרדלית Brassica juncea, צמח מודל לטיהור קרקע מזוהמת בקדמיום [89]. בנוסף, דו-פרק חופי מסוגל לספוח אורניום (U) ותוריום (Th) מהקרקע ולצבור אותם ברקמותיו, אם כי יעילותו בתחום זה נמוכה בהשוואה למינים אחרים שנבדקו [86]. בהשוואה לכרוב חרדלית, נמצא כי הוא יעיל יותר בספיחת לנתן (La), אך פחות יעיל בספיחת בריום 87,88] ].
פרט לפוטנציאל שלו להתפלת קרקע ולספיחת מתכות כבדות, מערכת השורשים העמוקה והמסועפת של דו-פרק חופי מסייעת לייצוב קרקע, בעיקר בדיונות חופיות, ומשפרת את עמידותן בפני שחיקה. בכך, הוא מספק שירותים אקולוגיים חיוניים לבתי הגידול הטבעיים שלו [90].
4.3. יתרונות סביבתיים של דו-פרק חופי
יכולתם של צמחי מלחה לשרוד בתנאים קיצוניים הופכת אותם למתאימים לפיטורמדיאציה (phytoremediation) – שיקום קרקעות ומקורות מים מזוהמים. לדו-פרק חופי יש מנגנון טבעי לקליטה ולצבירה של יוני נתרן וכלור ברקמותיו, מה שהופך אותו לצמח אידיאלי להסרת מלחים מקרקעות חקלאיות מלוחות ולשיקומן. באמצעות שילובו במחזורי גידול (crop rotation) או בגידול משולב (intercropping), ניתן להפחית את ריכוזי המלח בקרקע, לשפר את פוריותה ולהכשירה לגידולים מסורתיים [82]. בהקשר זה, פותחה שיטה הנקראת "חקלאות מעגלית מלוחה" (Circular Halophyte Mixed Farming – CHMF), המבוססת על גידול וקציר של צמחי מלחה באזורים מלוחים, במטרה לשקם את הקרקע ולהכשירה לשימוש חקלאי [83]. מודל זה נוסה בהצלחה עם מספר מיני צמחי מלחה שנמצאו יעילים במיוחד בספיחת מלחים ושיפור איכות הקרקע [84].
פרט ליכולתו לספוח מלחים, דו-פרק חופי מפגין גם רמות פעילות גבוהות של האנזים גלוטתיון-S-טרנספראז (Glutathione-S-transferase; GST), המשתתף בהמרה ביוכימית של תרכובות קסנוביוטיות – חומרים זרים כגון מזהמים סביבתיים ורעלנים אורגניים. נמצא כי דו-פרק חופי מציג סבילות גבוהה לקדמיום (Cd) ואף צובר אותו בגבעוליו. יתרה מזו, מקדם הטרנסלוקציה (translocation factor) של קדמיום בצמח זה גבוה מזה של כרוב החרדלית Brassica juncea, צמח מודל לטיהור קרקע מזוהמת בקדמיום [89]. בנוסף, דו-פרק חופי מסוגל לספוח אורניום (U) ותוריום (Th) מהקרקע ולצבור אותם ברקמותיו, אם כי יעילותו בתחום זה נמוכה בהשוואה למינים אחרים שנבדקו [86]. בהשוואה לכרוב חרדלית, נמצא כי הוא יעיל יותר בספיחת לנתן (La), אך פחות יעיל בספיחת בריום 87,88] ].
פרט לפוטנציאל שלו להתפלת קרקע ולספיחת מתכות כבדות, מערכת השורשים העמוקה והמסועפת של דו-פרק חופי מסייעת לייצוב קרקע, בעיקר בדיונות חופיות, ומשפרת את עמידותן בפני שחיקה. בכך, הוא מספק שירותים אקולוגיים חיוניים לבתי הגידול הטבעיים שלו [90].
4.4. שימושים נוספים של דו-פרק חופי
השימושים העיקריים של דו-פרק חופי תוארו בפרקים הקודמים, אך תכונותיו הכימיות הופכות אותו לאטרקטיבי גם עבור תעשיות נוספות. בשל הריכוז הגבוה של פלבנואידים ותרכובות פנוליות, המעניקים לו פעילות נוגדת חמצון חזקה, הצמח מהווה מקור פוטנציאלי לשימושים קוסמטיים ולמוצרי טיפוח עור [73,79]. שמן המופק מזרעי דו-פרק חופי מכיל חומצה אירוסית (Erucic acid, EA), חומצת שומן חד-בלתי-רווייה ארוכת שרשרת (C22:1), הידועה בהידרופוביות הגבוהה שלה ובעמידותה למים. בשל תכונות אלו, חומצה אירוסית מהווה חומר גלם חיוני בתעשיות שונות, בהן תעשיית השמנים התעשייתיים וחומרי הסיכה, ייצור פלסטיק וחומרים פולימריים, ותוספים לתעשיית הגומי.
היום, המקור העיקרי לחומצה אירוסית הוא זני כרוב הנפוס Brassica napus עתיר חומצה אירוסית (HEAR – High Erucic Acid Rapeseed), שאינם ראויים לצריכה אנושית. קיימים כיום תהליכי השבחה גנטית, כולל שימוש בהנדסה גנטית, שמטרתם להגדיל את תפוקת החומצה האירוסית ולהפחית את נוכחותן של חומצות שומן מתחרות [91]. דו-פרק חופי עשוי לשמש כחלופה בת-קיימא לגידול מסחרי של צמחים עתירי חומצה אירוסית, בעיקר באזורים מליחים שאינם מתאימים לגידולי שמן גליקופיטיים (רגישים למלח). יכולתו לגדול בקרקעות מלוחות ולהשקותו במים מליחים מעניקה לו יתרון חקלאי על פני גידולי שמן מסורתיים. עם זאת, נדרשים מחקרים נוספים לפיתוח זני דו-פרק חופי עתירי חומצה אירוסית ולשיפור שיטות מיצוי השמן מזרעיו, כך שיגיעו ליעילות הדומה לזו של זני כרוב נפוס מסחריים.
השונות הגנטית הגבוהה של דו-פרק חופי, הנובעת מהאבקה זרה והתפוצה הרחבה של זרעים [40], עשויה להוות אתגר חקלאי להשבחתו. עם זאת, שונות גנטית רחבה היא גם יתרון משמעותי והזדמנות בתוכניות השבחה, שכן היא מאפשרת איתור זנים מותאמים לתנאי אקלים ולצרכים חקלאיים ספציפיים. בהקשר זה, יש לציין כי דו-פרק חופי שייך למשפחת המצליבים, כמו כרוב הנפוס, מין הידוע ביכולתו הגבוהה ליצירת צמחים הפלואידיים כפולים (double haploid,) בתהליכים כגון אנדרוגנזה (androgenesis), שבה נוצרים צמחים הפלואידיים כפולים מתאים זכריים. לפיכך, פיתוח קווים הפלואידיים כפולים מהווה כיוון מבטיח להשבחת דו-פרק חופי [92].
לסיכום, טיפוח מסחרי של צמחי מלחה מבטיחים, ובהם דו-פרק חופי, עשוי לתרום לפיתוח כלכלי וחברתי באזורים חקלאיים שוליים, באמצעות יצירת מקורות הכנסה חדשים לחקלאים, צמצום העוני באזורים כפריים וחיזוק החוסן מפני השפעות שינויי האקלים.
5. מסקנות ותחזיות לעתיד
דו-פרק חופי הוא צמח קטן יחסית, מהיר גדילה, המפיק כ-10,000 זרעים במחזור גידול אחד [41,42]. תכונות אלו, יחד עם עמידותו הגבוהה למליחות כצמח מלחה מובהק, הופכות אותו למודל מחקר אידיאלי ללימוד תגובות צמחים לעקות מלח. מחקרים שונים חשפו מנגנונים ביוכימיים המסייעים לדו-פרק חופי להתמודד עם השפעותיה המזיקות של המליחות במהלך שלב הצמיחה הווגטטיבי, אך נותרו עדיין שאלות בלתי פתורות. בין השאר, לא ידוע מספיק על הצטברות אוסמוליטים נוספים מלבד פרולין, GABA וגליצין; על מסלול SOS המווסת את סילוק הנתרן מהציטופלזמה; וכן על ההבדלים האפשריים בין מנגנוני ההסתגלות של הצמח לרמות מליחות מתונות לעומת רמות קיצוניות. יתרה מכך, מרבית המחקרים על דו-פרק חופי התמקדו בשלב הצמיחה הווגטטיבית, בעוד שהתגובות הפיזיולוגיות והביוכימיות במהלך הפריחה והתפתחות מערכת הרבייה כמעט שלא נחקרו, למעט מחקרים שבחנו ייצור זרעים ונביטתם [52,56]. מעבר לחשיבותו כמודל מחקר, דו-פרק חופי הוא מועמד מבטיח בחקלאות מליחה (biosaline agriculture), בשל מגוון יישומיו הפוטנציאליים – כגידול מסחרי, צמח מאכל, צמח מרפא, מקור לחומרי גלם לתעשייה, וכן ככלי לשיקום קרקעות ומים מזוהמים (פיטורמדיאציה phytoremediation) ולשיקום קרקעות מלוחות במיוחד.
השונות הגנטית הגבוהה בתוך מין זה, הנובעת מהאבקה זרה ומפיזור נרחב של זרעים [40], מציבה אתגר בהשגת אחידות בתכונות הרצויות לשימוש חקלאי ומסחרי. עם זאת, שונות זו מהווה גם הזדמנות להשבחה, שכן היא מאפשרת זיהוי וברירה של זנים המותאמים לתנאי אקלים מגוונים ולצרכים חקלאיים שונים. בהקשר זה, חשוב לציין כי דו-פרק חופי שייך למשפחת המצליבים, כמו כרוב הנפוס Brassica napus, מין הידוע ביכולתו הגבוהה ליצור קווים הפלואידיים כפולים (Double Haploid,) באמצעות אנדרוגנזה (Androgenesis), תהליך שבו נוצרים צמחים הפלואידיים כפולים מתאים זכריים. לפיכך, פיתוח קווים הפלואידיים כפולים עשוי להוות כיוון מבטיח להשבחת דו-פרק חופי [92].
לסיכום, גידול מסחרי של צמחי מלחה בעלי פוטנציאל, כולל דו-פרק חופי, עשוי לתרום לפיתוח כלכלי-חברתי באזורים שאינם פוריים או שאינם מתאימים בקלות לעיבוד חקלאי. הרחבת השימוש במין זה עשויה לייצור מקורות פרנסה חדשים לחקלאים, לצמצם את העוני באזורים כפריים ולסייע בחיזוק החוסן של מערכות חקלאיות מפני שינויי האקלים.
ספרות
מאמר זה מבוסס על תרגום המאמר המקורי –
Mir R… and Vicente O 2024 Cakile maritima: A Halophyte Model to Study Salt Tolerance Mechanisms and Potential Useful Crop for Sustainable Saline Agriculture in the Context of Climate Change. Plants, 13,2880.
קישור למאמר: https://www.mdpi.com/2223-7747/13/20/2880
————————
- Corwin D.L., Scudiero E. Review of soil salinity assessment for agriculture across multiple scales using proximal and/or remote sensors. Adv. Agron. 2019;158:1–130. doi: 10.1016/bs.agron.2019.07.001. [DOI] [Google Scholar]
- Osman J.R., Regeard C., Badel C., Fernandes G., DuBow M.S. Variation of bacterial biodiversity from saline soils and estuary sediments present near the Mediterranean Sea coast of Camargue (France) Antonie Van Leeuwenhoek. 2019;112:351–365. doi: 10.1007/s10482-018-1164-z. [DOI] [PubMed] [Google Scholar]
- FAO Global Map of Salt-Affected Soils. [(accessed on 10 July 2024)]. Available online: https://www.fao.org/soils-portal/data-hub/soil-maps-and-databases/global-map-of-salt-affected-soils/en/
- Munns R., James R.A., Xu B., Athman A., Conn S.J., Jordans C., Byrt C.S., Hare R.A., Tyerman S.D., Tester M., et al. Wheat grain yield on saline soils is improved by an ancestral Na⁺ transporter gene. Nat. Biotechnol. 2012;30:360–364. doi: 10.1038/nbt.2120. [DOI] [PubMed] [Google Scholar]
- Melino V., Tester M. Salt-tolerant crops: Time to deliver. Annu. Rev. Plant Biol. 2023;74:671–696. doi: 10.1146/annurev-arplant-061422-104322. [DOI] [PubMed] [Google Scholar]
- Singh R.K., Mishra B. CSR30: First basmati rice variety for sodicity stress. Indian Farming. 2006;56:3–6. [Google Scholar]
- Ismail A.M., Horie T. Genomics, physiology, and molecular breeding approaches for improving salt tolerance. Annu. Rev. Plant Biol. 2017;68:405–434. doi: 10.1146/annurev-arplant-042916-040936. [DOI] [PubMed] [Google Scholar]
- Ali A.A.M., Romdhane W.B., Tarroum M., Al-Dakhil M., Al-Doss A., Alsadon A.A., Hassairi A. Analysis of salinity tolerance in tomato introgression lines based on morpho-physiological and molecular traits. Plants. 2021;10:2594. doi: 10.3390/plants10122594. [DOI] [PMC free article] [PubMed] [Google Scholar]
- James R.A., Blake C., Zwart A.B., Hare R.A., Rathjen A.J., Munns R. Impact of ancestral wheat sodium exclusion genes Nax1 and Nax2 on grain yield of durum wheat on saline soils. Plant Biol. 2012;39:609–618. doi: 10.1071/FP12121. [DOI] [PubMed] [Google Scholar]
- Li Y., Zhang Y., Feng F., Liang D., Cheng L., Ma F., Shi S. Overexpression of a Malus vacuolar Na+/H+ antiporter gene (MdNHX1) in apple rootstock M. 26 and its influence on salt tolerance. Plant Cell Tissue Organ Cult. 2010;102:337–345. doi: 10.1007/s11240-010-9738-0. [DOI] [Google Scholar]
- Gallasch P.T., Dalton G.S. Selecting salt-tolerant citrus rootstocks. J. Agric. Res. 1989;40:137–144. doi: 10.1071/AR9890137. [DOI] [Google Scholar]
- Dry I.B., Davies C., Dunlevy J.D., Smith H.M., Thomas M.R., Walker A.R., Clingeleffer P.R. Development of new wine-, dried- and table grape scions and rootstocks for Australian viticulture: Past, present, and future. Aust. J. Grape Wine Res. 2022;28:177–195. doi: 10.1111/ajgw.12552. [DOI] [Google Scholar]
- Coban A., Akhoundnejad Y., Dere S., Dasgan H.Y. Impact of salt-tolerant rootstock on the enhancement of sensitive tomato plant responses to salinity. 2020;55:35–39. doi: 10.21273/HORTSCI14476-19. [DOI] [Google Scholar]
- Sanwal S.K., Mann A., Kumar A., Kesh H., Kaur G., Rai A.K., Kumar R., Sharma P.C., Kumar A., Bahadur A., et al. Salt-tolerant eggplant rootstocks modulate sodium partitioning in tomato scion and improve performance under saline conditions. Agriculture. 2022;12:183. doi: 10.3390/agriculture12020183. [DOI] [Google Scholar]
- Arcadia Biosci. Final Report. Arcadia Biosci.; Davis, CA, USA: 2018. [(accessed on 10 July 2024)]. Accelerating development of abiotic stress tolerant rice and wheat. Available online: https://pdf.usaid.gov/pdf_docs/PA00TM4V.pdf. [Google Scholar]
- Giannelli G., Potestio S., Visioli G. The contribution of PGPR in salt stress tolerance in crops: Unravelling the molecular mechanisms of cross-talk between plant and bacteria. Plants. 2023;12:2197. doi: 10.3390/plants12112197. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Nikalje G.C., Srivastava A.K., Pandey G.K., Suprasanna P. Halophytes in biosaline agriculture: Mechanism, utilization, and value addition. Land Degrad. Dev. 2017;29:1081–1095. doi: 10.1002/ldr.2819. [DOI] [Google Scholar]
- Mann A., Lata C., Kumar N., Kumar A., Kumar A., Sheoran P. Halophytes as new model plant species for salt tolerance strategies. Front. Plant Sci. 2023;14:1137211. doi: 10.3389/fpls.2023.1137211. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Flowers T.J., Colmer T.D. Salinity tolerance in halophytes. New Phytol. 2008;179:945–963. doi: 10.1111/j.1469-8137.2008.02531.x. [DOI] [PubMed] [Google Scholar]
- Glenn E.P., Brown J.J., Blumwald E. Salt tolerance and crop potential of halophytes. Rev. Plant Sci. 1999;18:227–255. doi: 10.1080/07352689991309207. [DOI] [Google Scholar]
- Lombardi T., Bertacchi A., Pistelli L., Pardossi A., Pecchia S., Toffanin A., Sanmartin C. Biological and agronomic traits of the main halophytes widespread in the Mediterranean region as potential new vegetable crops. 2022;8:195. doi: 10.3390/horticulturae8030195. [DOI] [Google Scholar]
- Yensen N.P. Ecophysiology of High Salinity Tolerant Plants. Springer; Dordrecht, The Netherlands: 2006. Halophyte uses for the twenty-first century; pp. 367–396. [DOI] [Google Scholar]
- Aronson J. Salt-Tolerant Plants of the World. University of Arizona; Tucson, AZ, USA: 1989. [Google Scholar]
- Grigore M.N. Handbook of Halophytes: From Molecules to Ecosystems towards Biosaline Agriculture. Springer International Publishing; Cham, Switzerland: 2021. Definition and classification of halophytes as an ecological group of plants; pp. 3–50. [Google Scholar]
- Santos J., Al-Azzawi M., Aronson J., Flowers T.J. eHALOPH a database of salt-tolerant plants: Helping put halophytes to work. Plant Cell Physiol. 2016;57:e10. doi: 10.1093/pcp/pcv155. [DOI] [PubMed] [Google Scholar]
- Van Zelm E., Zhang Y., Testerink C. Salt tolerance mechanisms of plants. Annu. Rev. Plant Biol. 2020;71:403–433. doi: 10.1146/annurev-arplant-050718-100005. [DOI] [PubMed] [Google Scholar]
- Amtmann A. Learning from evolution: Thellungiella generates new knowledge on essential and critical components of abiotic stress tolerance in plants. Mol. Plant. 2009;2:3–12. doi: 10.1093/mp/ssn094. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Liu J., Ishitani M., Halfter U., Kim C.S., Zhu J.K. The Arabidopsis thaliana SOS2 gene encodes a protein kinase that is required for salt tolerance. Proc. Natl. Acad. Sci. USA. 2000;97:3730–3734. doi: 10.1073/pnas.97.7.3730. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Qiu Q.S., Guo Y., Dietrich M.A., Schumaker K.S., Zhu J.K. Regulation of SOS1, a plasma membrane Na+/H+ exchanger in Arabidopsis thaliana, by SOS2 and SOS3. Proc. Natl. Acad. Sci. USA. 2002;99:8436–8441. doi: 10.1073/pnas.122224699. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Jarvis D.E., Ryu C.H., Beilstein M.A., Schumaker K.S. Distinct roles for SOS1 in the convergent evolution of salt tolerance in Eutrema salsugineum and Schrenkiella parvula. Mol. Biol. Evol. 2014;31:2094–2107. doi: 10.1093/molbev/msu152. [DOI] [PubMed] [Google Scholar]
- Bose J., Rodrigo-Moreno A., Shabala S. ROS homeostasis in halophytes in the context of salinity stress tolerance. J. Exp. Bot. 2014;65:1241–1257. doi: 10.1093/jxb/ert430. [DOI] [PubMed] [Google Scholar]
- Kaleem M., Hameed M., Ahmad F., Ashraf M., Ahmad M.S.A. Anatomical and physiological features modulate ion homeostasis and osmoregulation in aquatic halophyte Fimbristylis complanata (Retz.) link. Acta Physiol. Plant. 2022;44:59. doi: 10.1007/s11738-022-03400-y. [DOI] [Google Scholar]
- Chang Y., Fan Y., Li Z., Lv G. Relationship between photosynthetic characteristics, anatomical structure, and physiological indexes of two halophytes in different habitats. 2022;13:2189. doi: 10.3390/f13122189. [DOI] [Google Scholar]
- Iqbal U., Hameed M., Ahmad F., Ahmad M.S.A., Naz N., Ashraf M., Kaleem M. Modulation of structural and functional traits in facultative halophyte Salvadora oleoides Decne. for adaptability under hyper-arid and saline environments. Arid Environ. 2023;213:104965. doi: 10.1016/j.jaridenv.2023.104965. [DOI] [Google Scholar]
- Grigore M.N., Toma C. Handbook of Halophytes: From Molecules to Ecosystems towards Biosaline Agriculture. Springer; Cham, Switzerland: 2021. Morphological and anatomical adaptations of halophytes: A review; pp. 1079–1221. [DOI] [Google Scholar]
- Yensen N.P., Biel K.Y. Soil remediation via salt-conduction and the hypotheses of halosynthesis and photoprotection. In: Khan M.A., Weber D.J., editors. Ecophysiology of High Salinity Tolerant Plants. Springer; Dordrecht, The Netherlands: 2006. pp. 313–344. [Google Scholar]
- Gandour M., Hessini K., Abdelly C. Understanding the population genetic structure of coastal species (Cakile maritima): Seed dispersal and the role of sea currents in determining population structure. Res. 2008;90:167–178. doi: 10.1017/S0016672308009269. [DOI] [PubMed] [Google Scholar]
- Ciccarelli D., Balestri M., Pagni A.M., Forino L.M.C. Morpho-functional adaptations in Cakile maritima Scop. subsp. maritima: Comparison of two different morphological types. 2010;63:411–421. doi: 10.1080/00087114.2010.10589754. [DOI] [Google Scholar]
- Barbour M.G. Seedling ecology of Cakile maritima along the California coast. Torrey Bot. Club. 1970;97:280–289. doi: 10.2307/2483647. [DOI] [Google Scholar]
- Davy A.J., Scott R., Cordazzo C.V. Biological flora of the British Isles: Cakile maritima Scop. J. Ecol. 2006;94:695–711. doi: 10.1111/j.1365-2745.2006.01131.x. [DOI] [Google Scholar]
- Debez A., Rejeb K.B., Ghars M.A., Gandour M., Megdiche W., Hamed K.B., Amor N.B., Brown S.C., Savouré A., Abdelly C. Ecophysiological and genomic analysis of salt tolerance of Cakile maritima. Exp. Bot. 2013;92:64–72. doi: 10.1016/j.envexpbot.2012.12.002. [DOI] [Google Scholar]
- Arbelet-Bonnin D., Ben-Hamed-Louati I., Laurenti P., Abdelly C., Ben-Hamed K., Bouteau F. Cakile maritima, a promising model for halophyte studies and a putative cash crop for saline agriculture. Agron. 2019;155:45–78. doi: 10.1016/bs.agron.2019.01.003. [DOI] [Google Scholar]
- Pakeman R.J., Lee J.A. The ecology of the strandline annuals Cakile maritima and Salsola kali. I. Environmental factors affecting plant performance. J. Ecol. 1991;79:143–153. doi: 10.2307/2260789. [DOI] [Google Scholar]
- Ben Hamed K., Custódio L. Ecophysiology, Abiotic Stress Responses and Utilization of Halophytes. Springer; Cham, Switzerland: 2019. How could halophytes provide a sustainable alternative to achieve food security in marginal lands; pp. 259–270. [DOI] [Google Scholar]
- Clausing G., Vickers K., Kadereit J.W. Historical biogeography in a linear system: Genetic variation of sea rocket (Cakile maritima) and sea holly (Eryngium maritimum) along European coasts. Mol. Ecol. 2000;9:1823–1833. doi: 10.1046/j.1365-294x.2000.01083.x. [DOI] [PubMed] [Google Scholar]
- Rodman J.E. Systematics and evolution of the genus Cakile (Cruciferae) Contrib. Gray Herb. Harv. Univ. 1974;205:3–146. doi: 10.5962/p.336437. [DOI] [Google Scholar]
- Ghars M.A., Debez A., Smaoui A., Zarrouk M., Grignon C., Abdelly C. Variability of fruit and seed-oil characteristics in Tunisian accessions of the halophyte Cakile maritima (Brassicaceae) In: Khan M.A., Weber D.J., editors. Ecophysiology of High Salinity Tolerant Plants. Springer; Dordrecht, The Netherlands: 2006. pp. 55–67. [DOI] [Google Scholar]
- Amor N.B., Jiménez A., Megdiche W., Lundqvist M., Sevilla F., Abdelly C. Response of antioxidant systems to NaCl stress in the halophyte Cakile maritima. Plant. 2006;126:446–457. doi: 10.1111/j.1399-3054.2006.00620.x. [DOI] [Google Scholar]
- Megdiche W., Amor N.B., Debez A., Hessini K., Ksouri R., Abdelly C. Physiological and biochemical traits involved in the genotypic variability to salt tolerance of Tunisian Cakile maritima. J. Ecol. 2009;47:774–783. doi: 10.1111/j.1365-2028.2009.01073.x. [DOI] [Google Scholar]
- Ksouri R., Megdiche W., Debez A., Falleh H., Grignon C., Abdelly C. Salinity effects on polyphenol content and antioxidant activities in leaves of the halophyte Cakile maritima. Plant Physiol. Biochem. 2007;45:244–249. doi: 10.1016/j.plaphy.2007.02.001. [DOI] [PubMed] [Google Scholar]
- Belghith I., Senkler J., Hildebrandt T., Abdelly C., Braun H.P., Debez A. Comparative analysis of salt-induced changes in the root proteome of two accessions of the halophyte Cakile maritima. Plant Physiol. Biochem. 2018;130:20–29. doi: 10.1016/j.plaphy.2018.06.029. [DOI] [PubMed] [Google Scholar]
- Debez A., Ben Hamed K., Grignon C., Abdelly C. Salinity effects on germination, growth, and seed production of the halophyte Cakile maritima. Plant Soil. 2004;262:179–189. doi: 10.1023/B:PLSO.0000037034.47247.67. [DOI] [Google Scholar]
- Debez A., Koyro H.W., Grignon C., Abdelly C., Huchzermeyer B. Relationship between the photosynthetic activity and the performance of Cakile maritima after long-term salt treatment. Plant. 2008;133:373–385. doi: 10.1111/j.1399-3054.2008.01086.x. [DOI] [PubMed] [Google Scholar]
- Debez A., Braun H.P., Pich A., Taamalli W., Koyro H.W., Abdelly C., Huchzermeyer B. Proteomic and physiological responses of the halophyte Cakile maritima to moderate salinity at the germinative and vegetative stages. Proteom. 2012;75:5667–5694. doi: 10.1016/j.jprot.2012.08.012. [DOI] [PubMed] [Google Scholar]
- Flowers T.J., Munns R., Colmer T.D. Sodium chloride toxicity and the cellular basis of salt tolerance in halophytes. Ann. Bot. 2015;115:419–431. doi: 10.1093/aob/mcu217. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Debez A., Taamalli W., Saadaoui D., Ouerghi Z., Zarrouk M., Huchzermeyer B., Abdelly C. Biosaline Agriculture and Salinity Tolerance in Plants. Birkhäuser Basel; Basel, Switzerland: 2006. Salt effect on growth, photosynthesis, seed yield and oil composition of the potential crop halophyte Cakile maritima; pp. 55–63. [DOI] [Google Scholar]
- Ellouzi H., Hamed K.B., Hernández I., Cela J., Müller M., Magné C., Abdelly C., Munné-Bosch S. A comparative study of the early osmotic, ionic, redox and hormonal signaling response in leaves and roots of two halophytes and a glycophyte to salinity. 2014;240:1299–1317. doi: 10.1007/s00425-014-2154-7. [DOI] [PubMed] [Google Scholar]
- Hamed-Laouti I.B., Arbelet-Bonnin D., De Bont L., Biligui B., Gakière B., Abdelly C., Hamed K.B., Bouteau F. Comparison of NaCl-induced programmed cell death in the obligate halophyte Cakile maritima and the glycophyte Arabidopsis thaliana. Plant Sci. 2016;247:49–59. doi: 10.1016/j.plantsci.2016.03.003. [DOI] [PubMed] [Google Scholar]
- Megdiche W., Amor N.B., Debez A., Hessini K., Ksouri R., Zuily-Fodil Y., Abdelly C. Salt tolerance of the annual halophyte Cakile maritima as affected by the provenance and the developmental stage. Acta Physiol. Plant. 2007;29:375–384. doi: 10.1007/s11738-007-0047-0. [DOI] [Google Scholar]
- Arbelet-Bonnin D., Blasselle C., Palm E.R., Redwan M., Ponnaiah M., Laurenti P., Meimoun P., Gilard F., Gakière B., Mancuso S., et al. Metabolism regulation during salt exposure in the halophyte Cakile maritima. Environ. Exp. Bot. 2020;177:104075. doi: 10.1016/j.envexpbot.2020.104075. [DOI] [Google Scholar]
- Ellouzi H., Sghayar S., Abdelly C. H2O2 seed priming improves tolerance to salinity, drought, and their combined effect more than mannitol in Cakile maritima when compared to Eutrema salsugineum. J. Plant Physiol. 2017;210:38–50. doi: 10.1016/j.jplph.2016.11.014. [DOI] [PubMed] [Google Scholar]
- Ellouzi H., Ben Hamed K., Cela J., Munné-Bosch S., Abdelly C. Early effects of salt stress on the physiological and oxidative status of Cakile maritima (halophyte) and Arabidopsis thaliana (glycophyte) Physiol. 2011;142:128–143. doi: 10.1111/j.1399-3054.2011.01450.x. [DOI] [PubMed] [Google Scholar]
- Amor N.B., Jiménez A., Megdiche W., Lundqvist M., Sevilla F., Abdelly C. Kinetics of the anti-oxidant response to salinity in the halophyte Cakile maritima. J. Integr. Plant Biol. 2007;49:982–992. doi: 10.1111/j.1672-9072.2007.00491.x. [DOI] [Google Scholar]
- Houmani H., Rodríguez-Ruiz M., Palma J.M., Abdelly C., Corpas F.J. Modulation of superoxide dismutase (SOD) isozymes by organ development and high long-term salinity in the halophyte Cakile maritima. 2016;253:885–894. doi: 10.1007/s00709-015-0850-1. [DOI] [PubMed] [Google Scholar]
- Jdey A., Slama I., Rouached A., Abdelly C. Growth, Na+, K+, osmolyte accumulation and lipid membrane peroxidation of two provenances of Cakile maritima during water deficit stress and subsequent recovery. Flora-Morphol. Distrib. Funct. Ecol. Plants. 2014;209:54–62. doi: 10.1016/j.flora.2013.10.002. [DOI] [Google Scholar]
- Farhat N., Belghith I., Senkler J., Hichri S., Abdelly C., Braun H.P., Debez A. Recovery aptitude of the halophyte Cakile maritima upon water deficit stress release is sustained by extensive modulation of the leaf proteome. Ecotoxicol. Environ. Saf. 2019;179:198–211. doi: 10.1016/j.ecoenv.2019.04.072. [DOI] [PubMed] [Google Scholar]
- Houmani H., Debez A., Freitas-Silva L.D., Abdelly C., Palma J.M., Corpas F.J. Potassium (K+) starvation-induced oxidative stress triggers a general boost of antioxidant and NADPH-generating systems in the halophyte Cakile maritima. Antioxidants. 2022;11:401. doi: 10.3390/antiox11020401. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Conversa G., Botticella L., Lazzizera C., Bonasia A., Elia A. Ecophysiological and nutritional characterisation of two morphotypes of Cakile maritima subsp. maritima Scop. from Puglia region, Southern Italy. Front. Plant Sci. 2024;15:1397852. doi: 10.3389/fpls.2024.1397852. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Ríos S., Obón C., Martínez-Francés V., Verde A., Ariza D., Laguna E. Handbook of Halophytes: From Molecules to Ecosystems Towards Biosaline Agriculture. Springer; Cham, Switzerland: 2020. Halophytes as food: Gastroethnobotany of halophytes; pp. 2639–2674. [Google Scholar]
- Barreira L., Reseka E., Rodrigues M.J., Rocha M.I., Pereira H., Bandarra N., Moreira da Silva M., Varela J., Custódio L. Halophytes: Gourmet food with nutritional health benefits? J. Food Compos. Anal. 2017;59:35–42. doi: 10.1016/j.jfca.2017.02.003. [DOI] [Google Scholar]
- Guil-Guerrero J.L., Giménez-Martínez J.J., Torija-Isasa M.E. Nutritional composition of wild edible crucifer species. J. Food Biochem. 1999;23:283–294. doi: 10.1111/j.1745-4514.1999.tb00020.x. [DOI] [Google Scholar]
- Guil-Guerrero J.G., Madrid P.C., Isasa M.T. Mineral elements determination in wild edible plants. Food Nutr. 1999;38:209–222. doi: 10.1080/03670244.1999.9991578. [DOI] [Google Scholar]
- Meot-Duros L., Le Floch G., Magné C. Radical scavenging, antioxidant and antimicrobial activities of halophytic species. Ethnopharmacol. 2008;116:258–262. doi: 10.1016/j.jep.2007.11.024. [DOI] [PubMed] [Google Scholar]
- Zarrouk M., El Almi H., Youssef N.B., Sleimi N., Smaoui A., Miled D.B., Abdelly C. Cash Crop Halophytes: Recent Studies: 10 Years After Al Ain Meeting. Springer; Dordrecht, The Netherlands: 2003. Lipid composition of seeds of local halophytes: Cakile maritima, Zygophyllum album and Crithmum maritimum; pp. 121–124. [DOI] [Google Scholar]
- Cordazzo C.V. Seed characteristics and dispersal of dimorphic fruit segments of Cakile maritima Scopoli (Brassicaceae) population of southern Brazilian coastal dunes. J. Bot. 2006;29:259–265. doi: 10.1590/S0100-84042006000200007. [DOI] [Google Scholar]
- Kramer J.K.G., Sauer F.D., Wolynetz M.S., Farnworth E.R., Johnston K.M. Effects of dietary saturated fat on erucic acid induced myocardial lipidosis in rats. 1992;27:619–623. doi: 10.1007/BF02536120. [DOI] [PubMed] [Google Scholar]
- Radwan H.M., Shams K.A., Tawfik W.A., Soliman A.M. Investigation of the glucosinolates and lipids constituents of Cakile maritima (Scope) growing in Egypt and their biological activity. J. Med. Med. Sci. 2008;3:182–187. [Google Scholar]
- Stefansson R., Hougen F.W. Selection of rape plants (Brassica napus) with seed oil practically free from erucic acid. J. Plant Sci. 1964;44:359–364. doi: 10.4141/cjps64-069. [DOI] [Google Scholar]
- Merchaoui H., Hanana M., Ksouri R. Ethnobotanical and phytopharmacological notes on Cakile maritima. 2018 doi: 10.3166/phyto-2019-0160. [DOI] [Google Scholar]
- Sotelo T., Lema M., Soengas P., Cartea M.E., Velasco P. In vitro activity of glucosinolates and their degradation products against Brassica-pathogenic bacteria and fungi. Appl. Environ. Microbiol. 2015;81:432–440. doi: 10.1128/AEM.03142-14. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Fuochi V., Barbagallo I., Distefano A., Puglisi F., Palmeri R., Di Rosa M., Tibullo D. Biological properties of Cakile maritima Scop. (Brassicaceae) extracts. Eur. Rev. Med. Pharmacol. Sci. 2019;23:2280–2292. doi: 10.26355/eurrev_201903_17277. [DOI] [PubMed] [Google Scholar]
- Navarro-Torre S., Garcia-Caparrós P., Nogales A., Abreu M.M., Santos E., Cortinhas A.L., Caperta A.D. Sustainable agricultural management of saline soils in arid and semi-arid Mediterranean regions through halophytes, microbial and soil-based technologies. Exp. Bot. 2023;212:105397. doi: 10.1016/j.envexpbot.2023.105397. [DOI] [Google Scholar]
- Toderich K., Yasui H., Akinshiuna N., Naoko M., Endo R., Khujanazarov T., Shikineav A., Sultanova Z., Qurbanov A., Yamanaka N., et al. Circular halophytes mixed farming (CHMF) to improve food security in salt-affected irrigated arid and semi-arid ecosystems. Arid Land Stud. 2022;32:71. doi: 10.14976/jals.32.3_71. [DOI] [Google Scholar]
- Garcia J.S., França M.G.C., Prasad M.N.V. Handbook of Halophytes: From Molecules to Ecosystems towards Biosaline Agriculture. Springer; Cham, Switzerland: 2020. Haloremediation for amelioration of salinity; pp. 2173–2190. [DOI] [Google Scholar]
- Dos Santos R.N., Machado B.R., Hefler S.M., Zanette J. Glutathione S-transferase activity in aquatic macrophytes and halophytes and biotransformation potential for biocides. Plant Res. 2021;134:577–584. doi: 10.1007/s10265-021-01266-8. [DOI] [PubMed] [Google Scholar]
- Hegazy A.K., Emam M.H. Accumulation and soil-to-plant transfer of radionuclides in the Nile Delta coastal black sand habitats. J. Phytoremediation. 2010;13:140–155. doi: 10.1080/15226511003753961. [DOI] [PubMed] [Google Scholar]
- Bouslimi H., Dridi N., Ferreira R., Brito P., Caçador I., Hidouri S., Sleimi N. Appraisal of the physiological response of Cakile maritima and Brassica juncea for tolerating lanthanum stress. Mar. Sci. Eng. 2023;12:65. doi: 10.3390/jmse12010065. [DOI] [Google Scholar]
- Bouslimi H., Ferreira R., Dridi N., Brito P., Martins-Dias S., Caçador I., Sleimi N. Effects of barium stress in Brassica juncea and Cakile maritima: The indicator role of some antioxidant enzymes and secondary metabolites. 2021;90:145–158. doi: 10.32604/phyton.2020.011752. [DOI] [Google Scholar]
- Taamalli M., Ghabriche R., Amari T., Mnasri M., Zolla L., Lutts S., Ghnaya T. Comparative study of Cd tolerance and accumulation potential between Cakile maritima L. (halophyte) and Brassica juncea L. Ecol. Eng. 2014;71:623–627. doi: 10.1016/j.ecoleng.2014.08.013. [DOI] [Google Scholar]
- Gallego-Fernández J.B., Sánchez I.A., Ley C. Restoration of isolated and small coastal sand dunes on the rocky coast of northern Spain. Eng. 2011;37:1822–1832. doi: 10.1016/j.ecoleng.2011.06.017. [DOI] [Google Scholar]
- Wang P., Xiong X., Zhang X., Wu G., Liu F. A review of erucic acid production in Brassicaceae oilseeds: Progress and prospects for the genetic engineering of high and low-erucic acid rapeseeds (Brassica napus) Front. Plant Sci. 2022;13:899076. doi: 10.3389/fpls.2022.899076. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Pechan P.M., Keller W.A. Identification of potentially embryogenic microspores in Brassica napus. Plant. 1988;74:377–384. doi: 10.1111/j.1399-3054.1988.tb00646.x. [DOI] [Google Scholar]
- י גרנות 2024 הפרשת נוזלים מימיים בעצים; תצפיות בצפצפת הפרת ובאלה אטלנטית. כתב-עת "כלנית", מספר 10.
==================
כל הזכויות שמורות ל"כלנית" ©
לציטוט: Mircea M R et al. 2025 צמח דו-פרק חופי: מודל לחקר מנגנוני עמידות למלח כצמח מלחה וכבעל פוטנציאל לגידול בחקלאות מליחה בת-קיימא בהקשר לשינויי האקלים.. כתב-עת "כלנית", מספר 11.
==================











